Calor sensible
| ||||||
Calor sensible. Cantidad de calor que absorbe o libera un cuerpo sin que en el ocurran cambios en su estado físico (cambio de fase). Cuando a un cuerpo se le suministra calor sensible en este aumenta la temperatura.
Sumario
Calor
Se designa con el nombre de calor (Q) a la energía en tránsito que fluye desde una parte de un sistema a otra o de un sistema a otro, en virtud únicamente de una diferencia de temperatura.
En física encontramos definidos varios tipos de calores para una mejor comprensión y entendimiento de los diferentes procesos y fenómenos que ocurren en las sustancias y los cuerpos, así se puede definir el calor sensible, calor latente y el calor específico.
Calor sensible es aquel que un cuerpo o sustancia es capaz de absorber o ceder sin que por ello ocurran cambios en su estructura molecular, o sea, en su estado físico.
El calor absorbido o cedido depende de la presión que sobre ella se ejerce, tomando como referencia la temperatura de 0o C. A mayor presión, mayor calor sensible y a menor presión, menor calor sensible.
Suministrar calor sensible
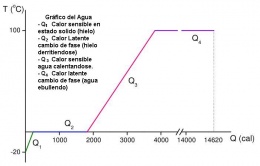
Cuando se calienta una sustancia que tiene una temperatura inferior a su punto de ebullición, absorbe calor y aumenta su temperatura (calor sensible), hasta alcanzar el punto de ebullición correspondiente a la presión a que esté sometida, luego de alcanzado este se detiene el ascenso de la temperatura y cualquier cantidad adicional de calor que se le suministre ya no aumentará la temperatura.
Ejemplo: cuando se calienta agua a presión atmosférica, ésta absorbe calor sensible y su temperatura se eleva progresivamente, hasta que comienza a ebullir, estabilizándose entonces a 100o C.
Si el calentamiento ocurre a presión inferior a la atmosférica entonces el agua comenzará a ebullir a temperatura inferior a 100o C, pues el punto de ebullición disminuye, requiriendo menos calor sensible para alcanzar este punto a partir del cual el calor suministrado recibirá el nombre de calor latente.
La cantidad de calor necesaria para calentar o enfriar un cuerpo es directamente proporcional a la masa del cuerpo, la presión a que esta sometido y a la diferencia de temperaturas entre el foco frío y caliente.
Condiciones para que no ocurran variaciones
Para ello resulta imprescindible fijar condiciones para que no ocurran variaciones en los puntos de cambio de estado de las sustancias, por tanto:
A presión constante
- Qs = ΔH = mCp(t2 − t1)
Donde:
- H es la entalpía del sistema,
- m es la masa del cuerpo,
- Cp es el calor específico a presión constante (definido como la cantidad de calor requerida para aumentar en un grado la temperatura de la unidad de masa de un cuerpo a presión constante),
- t2 es la temperatura final,
- t1 es la temperatura inicial del cuerpo.
A volumen constante Qs = ΔU = mCv(t2 − t1) Donde:
- Cv es el calor específico a volumen constante,
- U representa la energía interna del sistema.
Los valores de calor específico varían con la sustancia,la temperatura ambiente y el estado de agregación, ejemplo:
| Sustancia | Calor específico | Significado |
|---|---|---|
| Agua | 1 cal/g o C | Para elevar en 1 grado centígrado la temperatura de 1 g de agua, se requiere 1 caloría. |
| Aluminio | 0,217 cal/g o C | Para elevar en 1 grado centígrado la temperatura de 1 g de aluminio se requieren 0,217 calorías. |
Enlace externo
Fuentes
- ing. Santibañez,María C. Tecnología Azucarera. Centro Nacional de Capacitación Azucarera MINAZ. Ciudad de la Habana, Cuba, 1983.
- Calor específico Calorimetría