Cinética de degradación del naftaleno
| ||||||
Cinética de degradación del naftaleno Numerosas han sido las investigaciones sobre el estudio de la biorremediación para su aplicación en la lucha para combatir la contaminación ambiental por hidrocarburos. El Instituto de Oceanología del Ministerio de Ciencia, Tecnología y Ambiente, ha trabajado desde 1988 en el aislamiento y conservación de bacterias marinas que sean capaces de degradar el petróleo por células inmovilizadas húmedas de bacillus alcalophilus cepa IDO-225 strain.
Sumario
Determinación de la cinética de degradación de naftaleno
Con la finalidad de caracterizar la cinética de consumo y degradación de naftaleno, se iniciaron cultivos líquidos de cada una de las cepas aisladas y caracterizadas, y del inoculo obtenido por repique consecutivo de la muestra original, en 100 ml de MMB líquido con naftaleno al 0,2 %p/v como única fuente de carbono y energía. Todos los medios se incubaron en shaker con agitación a 180 rpm, a 28 ºC, durante el lapso de 3 días. La cantidad de inoculo empleado se normalizó en todos los casos, de modo tal de sembrar en cada medio el equivalente a 0,5 puntos de absorbancia a una longitud de onda de 600 nm (DO600).
Durante el intervalo de cultivo, se procedió a la colecta de muestras de 1 ml por vez de cada medio, cada 12 horas, de modo de cumplimentar la toma de dos muestras diarias durante el tiempo total del ensayo. Cada una de las muestras fue empleada en la determinación de la biomasa presente en el cultivo y en la determinación del grado de consumo de la fuente de carbono, al tiempo correspondiente. Para ello, en forma inmediata al muestreo, se fraccionó cada muestra en dos alícuotas de 500 μl cada una. A una de éstas, se le realizó una medición de DO600, efectuándosele previamente la dilución que fuese necesaria. Esta determinación se realizó en forma inmediata a la toma de muestra, para evitar sobreestimación de la medición debido a la continuidad del crecimiento luego de tomada la alícuota.
Por su parte, el consumo de naftaleno se comprobó de forma indirecta mediante la determinación de la concentración de ácido salicílico generado por la degradación de dicho sustrato, a los distintos tiempos de trabajo. Para cuantificar este producto, se empleó un método colorimétrico que consiste en la medición de la absorbancia a 540 nm de un complejo coloreado formado entre el salicilato y el ion férrico, utilizando en cada caso la alícuota remanente de la muestra a cada tiempo. La misma se centrifugó a 12000 rpm durante 5 minutos inmediatamente después de la recolección de la muestra, de modo tal de evitar al máximo que el sustrato continué degradándose a salicilato, y por ende, se sobreestime el valor instantáneo del naftaleno al tiempo dado. Por otro lado, se realiza una curva de calibración, empleando una solución madre de ácido salicílico 0,1 M para la construcción de patrones del salicilato, y como reactivo colorimétrico, una solución de FeCl3 al 5% p/v.
Se empleó una cuba de cuarzo para la medición espectrofotométrica. Se colocaron en la misma 2 ml de cada solución patrón y se procedió a medir la absorbancia a 540 nm. Se confeccionó una curva de calibración ajustando los valores de absorbancia versus concentración de salicílico a una recta mediante regresión lineal.
La ecuación resultante correspondiente a la calibración empleada fue la siguiente:
y = 1587,8. x + 0,034, con un R2=0,9991
Se empleó la ecuación de la curva resultante para calcular la absortividad molar y las posteriores mediciones de concentración de salicilato, correspondientes a cada uno de los tiempos. En estos casos, se utilizó la mayor concentración final del reactivo colorimétrico (considerado en exceso frente las concentraciones de salicilato a las que se trabaja), realizándose las diluciones pertinentes para que la determinación se ajuste a los valores empleados en la calibración. Junto a la medición de cada muestra, se midió la absorción de una de las soluciones patrones, para corregir los valores de absorbancia a cada tiempo debido a errores instrumentales.
Características
En la actualidad, cuenta con cuatro bioproductos degradadores de petróleo en medio marino denominados BIOIL, K-BIOIL, BIOIL-FC e IDO-225.
Por Espectroscopía Infrarroja de muestras extraídas a los 3, 6, 9, 12 y 15 días de contacto de las células húmedas inmovilizadas de Bacillus alcalophilus Cepa IDO-225 en el medio de degradación con el naftaleno, un hidrocarburo del petróleo, que estás son capaces de degradar el naflateno como única fuente de carbono y energía.
Las células inmovilizadas húmedas de Bacillus alcalophilus cepa IDO-225 son capaces de utilizar el naftaleno como única fuente de carbono y energía. El mecanismo propuesto para oxidación del naftaleno se basa en la metil-oxidación y en la oxidación.
La biorremediación
La Biorremediación es la adición de materiales a medio ambientes contaminados para acelerar los procesos de biodegradación natural. Es conocida como el principal proceso natural para eliminar del medio ambiente las fracciones no volátiles del petróleo, por lo que permite reducir notablemente las concentraciones de petróleo residual.
Esto contribuye de modo muy efectivo a que se garantice una rápida y adecuada recuperación del área impactada por el derrame.
La biodegradación microbiana es un proceso lento, que está determinado por numerosos factores como la concentración y estructura química de las sustancias a degradar, tipo y concentración de microorganismo y factores físicos y químicos.
Las condiciones ambientales desfavorables influyen en el desarrollo de los microorganismos degradadores. Entre estas condiciones ambientales están: las bajas temperaturas existentes en el mar, la alta salinidad, la cual influye en la permeabilidad de la membrana celular, las bajas concentraciones de nutrientes, específicamente Nitrógeno y Fósforo, así como bajas concentraciones de oxígeno disuelto.
Las características moleculares del hidrocarburo son un factor importante a tener en cuenta, ya que determinan la solubilidad del hidrocarburo en agua y definen la velocidad y los mecanismos de ataque del microorganismo.
El número de átomos de carbono, las ramificaciones, los anillos (aromáticos o no, su número y ubicación) y la presencia de sustituyentes, confieren ciertas particularidades a algunas etapas del proceso de biotransformación para determinados hidrocarburos.
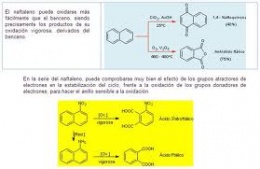
En el caso de los hidrocarburos aromáticos, que comprende al Benceno (C6H6) y sus homólogos superiores, es más complejo el mecanismo de biodegradación. Los átomos de carbono están asociados en anillos, pero solamente una valencia de cada dos, es saturada.
Al producirse la oxidación del anillo, éste se abre por un doble enlace y se obtienen compuestos oxigenados lineales, cuya degradación es más fácil. Así, en dependencia del microorganismo y del hidrocarburo en cuestión, se obtienen diferentes productos intermedios.
El Instituto de Oceanología trabaja en el aislamiento y conservación de bacterias marinas degradadoras de petróleo y cuenta con un bioproducto llamado BIOIL formado por cepas del género Bacillus, capaces de llevar a cabo la degradación de hidrocarburos con gran eficiencia y tiene la ventaja de no incluir nutrientes en su formulación.
De las cepas integrantes de este bioproducto, se demostró por Cromatografía Gaseosa de Alta Resolución, que la cepa IDO-225 es la responsable del alto porcentaje de actividad, razón por la cual fue la escogida para el desarrollo de este estudio.
Materiales y métodos
Microorganismo empleado El trabajo fue realizado con Bacillus alcalophilus cepa IDO-225, aislada de los sedimentos de la plataforma cubana en la Bahía de Cárdenas, Matanzas perteneciente a la Colección de Bacterias Marinas (CBM) del Instituto de Oceanología.
Medios de Cultivo Para la conservación del Bacillus alcalophilus se utilizó el medio 6 agarizado para bacterias marinas heterótrofas según Gorbienko12 y la fermentación para la obtención de la biomasa microbiana se realizó según Núñez.
En la degradación de naftaleno por las células inmovilizadas de Bacillus alcalophilus se empleó un medio que contenía naftaleno (30 g/L) disueltos en 1L de agua de mar.
Obtención del bioproducto inmovilizado Para obtener la biomasa, el cultivo se sedimentó a 700 xg en una centrífuga refrigerada Berkman (USA). Las células fueron inmovilizadas por atrapamiento en gel según la metodología descrita por Bellota.
Evaluación de la capacidad degradadora de Bacillus alcalophilus cepa IDO-225
Se realizó un experimento por bloques completamente aleatorizado, con las células de IDO-225 inmovilizadas húmedas en el medio de degradación.
La capacidad degradadora se determinó inoculando 0.5 g de cada bioproducto en frascos Erlenmeyers de 250 mL de capacidad, que contenían 50 mL de medio de degradación. Como control se utilizó medio de cultivo estéril. Los experimentos se realizaron en zaranda orbital rotatoria Infors (Suiza) a125 r/min y 30 ºC durante15 días.
Se tomaron muestras cada 3 días para la determinación de la concentración de hidrocarburos según Dubois.14
Estudio del posible mecanismo de degradación El hidrocarburo residual y el resto de los componentes orgánicos del proceso fermentativo fueron recuperados cada 3 días mediante tres extracciones sucesivas con 50 mL del solvente (CCL4) (1:1) (v/v) en la fase orgánica, las cuales fueron posteriormente deshidratadas con Na2SO4. El análisis cualitativo y cuantitativo de los hidrocarburos de la fase orgánica se realizó por Espectroscopía infrarrojo en un Konik de fabricación norteamericana.
Tratamiento estadístico de los resultados Para el procesamiento estadístico de los resultados se utilizó el análisis de varianza de clasificación simple 15 y la prueba de comparación de medias de rangos múltiples de Duncan. Todos los experimentos se llevaron a cabo por triplicado.
Cinética de oxidación del naftaleno por células inmovilizadas húmedas de Bacillus alcalophilus Cepa IDO-225] Las células inmovilizadas se encuentran en un estado de no crecimiento y utilizan la fuente de carbono fundamentalmente para la obtención de energía de mantenimiento. 10 Los resultados del estudio con las células inmovilizadas de B. alcalophilus utilizando naftaleno como fuente de carbono y energía en medio de degradación.
La curva de concentración de naftaleno muestra la transformación de este sustrato por el microorganismo inmovilizado. Los niveles de este hidrocarburo disminuyeron rápidamente en los primeros 6 días, posteriormente continúan disminuyendo lentamente alcanzando un alto porcentaje de remoción al final del proceso.
Modelo cinético de degradación R2 Células libres dC/dt = -0.0693C2+0.5366C-0.8 0.9620 Células inmovilizadas dC/dt = -0.0580C2-0.2667C+0.3 0.9770
El modelo cinético de segundo orden obtenido durante el proceso de biodegradación del naftaleno por células inmovilizadas húmedas de Bacillus alcalophilus cepa IDO-225 (Tabla 1), según algunos científicos, se corresponde con un mecanismo de metil-oxidación representado por el coeficiente del término cuadrático y una oxidación por el coeficiente del término de primer orden.
Según los resultados, el modelo cinético y la velocidad a la que ocurrió el proceso, es poco probable que ocurran mecanismos de oxidación, que son más lentos y menos comunes en la estrategia degradativa de los microorganismos frente a los hidrocarburos.
El mecanismo inicial en todo proceso de oxidación de hidrocarburos es la metil-oxidación. Al comparar los modelos cinéticos de segundo orden de la degradación de naftaleno por células inmovilizadas húmedas y células libres 19 de Bacillus alcalophilus, es necesario mencionar que en el caso de las células inmovilizadas pueden obtener energía suficiente y fácilmente para el mantenimiento celular a través de la metil-oxidación, por esta razón en el modelo cinético de esta variante el término cuadrático es mayor.
Sin embargo en las células libres 19 se observó que el coeficiente correspondiente a la oxidación es mayor que en las células inmovilizadas, porque se requiere de la síntesis de material celular para la multiplicación acompañado de un gran requerimiento energético.
Mediante el mecanismo de oxidación de naftaleno por células inmovilizadas de Bacillus alcalophilus se obtiene acetil-CoA, que se incorpora directamente al ciclo de los ácidos tricarboxílicos, para garantizar la síntesis de compuestos esenciales y la obtención de energía. El paso determinante en la velocidad de degradación del naftaleno es la metil-oxidación.
El coeficiente de este mecanismo es mayor en las células inmovilizadas con respecto a las células libres 19, por lo que la velocidad global del proceso de biodegradación del naftaleno por Bacillus alcalophilus es mayor en el caso de las células inmovilizadas húmedas.
Esto se debe a que las células libres, necesitan no sólo de fuente de carbono, sino de otros nutrientes para poder llevar a cabo sus procesos metabólicos.
Sin embargo cuando están inmovilizadas, se encuentran en un estado de no crecimiento, ya que el medio se encuentra desbalanceado, ocurriendo la transformación del sustrato por un mecanismo de bioconversión donde la célula transforma el sustrato y además, obtiene la energía de mantenimiento a partir de la fuente de carbono.
Resultados similares fueron obtenidos por otros científicos en 1990 cuando lograron un 30 % de degradación de crudo con Candida parapsilosis inmovilizada en arcilla en 4 semanas y sin embargo con células libres necesitaron 8 semanas para alcanzar igual nivel de degradación.
Bibliografía
- Chhatre S., Purohit H., Shanker R., Khanna P. Bacterial consortia for crude oil spill remediation, 18. Biennial Conference of the IAWQ, (Singapore), 23-28 Jun 1996.
- Prince R.C. Petroleum spill bioremediation in marine environments, Crit. Rev. Microbiol. 19: 217-242, 1993.
- Kirby M. F. y Matthiessen, R. J. Procedures for the approval of oil spill treatment products, Fish. -Res. -Tech. -Rep. -Dir. -Fish. -Res.-G.B. Lowestoft,-UK Ministry-of-Agricultur,-Fisheries-and-Food 1996, 102:19, 1996.
- Bergueiro J.R. y Dominguez F. Dispersantes químicos y mareas negras, 195pp., 1992.
- Al-Gounaim M.Y.y Diab A. Ecological Distribution and Biodegradational Activities of Oil-Degrading Marine Bacteria in the Arabian Gulf Water at Kuwait, Arab-Gulf-J-Sci-Res vol. 16 (2):359-377, 1998
- Solanás, A.M. Biodegradación microbiana en la contaminación por hidrocarburos. Mundo Científico 1 (8): 913-920, 1985.
- Bouchez M., Blanchet D.y Vandecasteele J. P. Substrate availability phenantrene biodegradation: transfer mechanism and influence on metabolism, Appl. Microb. Biotechnol., Oct. 43(5):952-960, 1995.
- Sirvins, A. y Tramier, B. Biodegradation of hydrocarbons. Recherche 16 (171), 1985.
- Bellota M., Fonseca E.L., Núñez R.R., Martínez J., Villaverde M. J., Joseph N.y Fuentes M. Bioproducto para combatir la contaminación por hidrocarburos de petróleo y sus derivados, Certificado #22323, C12N, 11/02: CO2F 3/34, 1994.
- Núñez, R. R.; Oramas, J; Fonseca, E.L.; López, J.S.; Ortiz, E.; Barbán, O.; Cabranes, Y y Martínez, C. Informe del proyecto ejecutivo de CESIGMA SA. Aplicación de la Biorremediación para mitigar los efectos de un derrame de petróleo en la Playa Jibacoa, 2001.
- Joseph, N.; Capó, M.C.; Bellota, M.; Ramos, Y. y Fuentes, M. Aislamiento y selección de microorganismos degradadores de hidrocarburos en la plataforma cubana. Ciencias Biológicas. Microbiología. 27:137-148, 1994.
- Gorbienko Y. A. Sobre las ventajas cualitativas del agar nutriente en medios de cultivos para microorganismos heterótrofos, Mikrobiol, 30(1):168-172, 1961.
- Núñez R. Obtención del bioproducto IDO-225 para combatir derrames de petróleo en el mar, Tesis para optar por el Título de Maestro en Ciencias. Universidad de La Habana, 1998.
- Dubois, M., Gilles, K. A.., Hamilton, J. K.., Rebers, P. A. y Smith, F. Colorimetric method of determination of sugars and related substances. Anal. Chem. 28:350, 1956.
- Lerch G. La experimentación en las ciencias biológicas y agrícolas, Editorial Científico Técnica. La Habana. Capítulo 16: Análisis de Varianza. Clasificación triple: 251-277, 1977.
- Duncan D. R. Multiple range multiple F-Test biometrics, 11:1-42, 1965.
- Head I. Bioremediation: toward a credible technology, Microbiology, 144: 599-608, 1998.
- Núñez, R.R. Biorremediación de derrame de hidrocarburos en ecosistemas marinos. Obtención, caracterización y aplicación de un bioproducto bacteriano. Tesis de Doctorado, 2002.
- Núñez, R.R.; Cabranes, Y.; Ortiz, E.; Gondres, R.; Martínez, C.y Martínez, J. Cinética de degradación del naftaleno por Bacillus alcalophilus cepa IDO-225. Avicennia (en prensa), 2002.
- Lehninger .A. Bioquímica. Ed. Revolucionaria. Cap.18, 19 y 20. 487-570pp., 1986.
- Omar S.H.; Buedecker U. y Rehm H.J. Degradation of oily sludge from a flotation unit by free and inmovilized microorganism,. Appl. Microbiol. Biotechnol, 34(2):259-263, 1990.
Fuentes
- http://www.federacionentidades.org.ar/unqtrabajo.htm
- RINCON G, América y SOUTIF, Jean-Claude . Modificación de poli (ácido metacrílico) con derivados 2- oxazolina de ácidos bioáctivos: ácido 1-naftil acético. Rev. Téc. Ing. Univ. Zulia. 2007, vol.30, n.1 [citado 2012-07-10], pp. 85-95 . Disponible en: <http://www.scielo.org.ve/scielo.php?script=sci_arttext&pid=S0254-07702007000100010&lng=es&nrm=iso>. ISSN 0254-0770.
- http://noticiashistorianatural.blogspot.com/2012/03/identifican-bacterias-marinas-capaces.html
- http://bioprocesos.unq.edu.ar/Biorremediacion/B&B%20finales%202007/Naftaleno%20RDQ.pdf
- http://ojs.uo.edu.cu/index.php/tq/article/viewFile/2089/1638