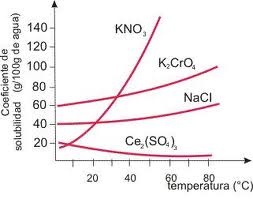
Curva de solubilidad
En la Curva de solubilidad el coeficiente de solubilidad representado depende de la temperatura, de la naturaleza del soluto, de la naturaleza del disolvente y de la presión. Para el caso de un sólido disuelto, la influencia de la presión en muy pequeña. Al elevar la temperatura, el coeficiente de solubilidad aumenta si el fenómeno de disolución a temperatura constante es endotérmico (es el caso más frecuenta), y disminuye en caso contrario.
Sumario
Coeficiente de Solubilidad
Los resultados se traducen en las llamadas curvas de solubilidad, que son representaciones gráficas de la solubilidad de un soluto en función de la temperatura. En resumen el coeficiente de solubilidad depende principalmente de:
- En la solubilidad influyen la naturaleza del soluto, la del disolvente y la temperatura.
- Se llaman curvas de solubilidad a las representaciones gráficas de la solubilidad de un soluto en función de la temperatura.
Como has visto la solubilidad depende de cada sustancia que entre en disolución. A continuación te presentamos un applet donde puedes seleccionar cationes, aniones y distintos compuestos para estudiar la solubilidad, pulsa el botón para empezar.
Disolución
Una disolución es una mezcla de dos o más sustancias.
El soluto es la sustancia presente en menor cantidad, y el disolvente es la sustancia que está en mayor cantidad.
Clasificación de las disoluciones
Se dice que una disolución se encuentra saturada cuando contiene la máxima cantidad de un soluto que se disuelve en un disolvente particular, a una temperatura específica.
Una disolución es no saturada cuando contiene menos cantidad de soluto que la que puede disolver. Una disolución se encuentra sobresaturada cuando contiene más soluto que el que puede haber en una disolución sobresaturada.
En este sentido, el proceso de disolución está relacionado con la solubilidad, la cual está referida a la proporción en que un soluto se disuelve en un solvente. Los factores importantes que afectan la solubilidad de los sólidos cristalinos son la temperatura, la naturaleza del solvente y la presencia de otros iones en la solución. En virtud de que nuestro interés de estudio es la dependencia de la solubilidad con la temperatura haremos un breve comentario acerca de dicho factor.
De acuerdo a lo expresado por Sienko y Plane, la mayoría de las sales inorgánicas aumentan en solubilidad cuando la temperatura se incrementa. Por lo general es ventajoso llevar a cabo en solución caliente las operaciones de precipitación, filtración y lavado, pues con esto pueden resultar partículas de gran tamaño, la filtración es más rápida y las impurezas se disuelven más rápidamente. Sin embargo, en el caso de un compuesto bastante soluble, como el Nitrato dePotasio (KNO3), la solución se debe enfriar en agua helada antes de la filtración, lo cual se conoce como sobreenfriamiento de la solución. Si la solución se filtrara caliente se perdería una cantidad apreciable del compuesto en cuestión.
El proceso de sobreenfriamiento de una solución es cuando un líquido se enfría temporalmente por debajo de su punto de congelación sin formar el sólido. Se presenta en situaciones donde el calor del líquido se elimina tan rápido que las moléculas no tienen tiempo de acomodarse en la estructura de un sólido.
Ahora bien, las atracciones intermoleculares que mantienen juntas a las moléculas en líquidos y sólidos también tienen un papel importante en la formación de las disoluciones. Cuando una sustancia (el soluto) se disuelve en otra (el disolvente), las partículas del soluto se dispersan en el disolvente. Las partículas de soluto ocupan posiciones que estaban ocupadas por moléculas del disolvente.
Según Raymond Chang, la facilidad con la que una partícula de soluto sustituye a una molécula de disolvente depende de la fuerza relativa de tres tipos de interacciones: interacción disolvente-disolvente, interacción soluto-soluto e interacción disolvente-soluto. Así, la solubilidad de un soluto en un solvente dado se relaciona con la temperatura por el
Calor de Disolución
Es la energía necesaria para disolver una sustancia hasta la saturación. Si la atracción soluto-disolvente es mayor que la atracción disolvente-disolvente y que la atracción soluto-soluto, el proceso de disolución será favorable, o exotérmico (ΔH disolución < 0). Si la interacción soluto-disolvente es más débil que las interacciones disolvente-disolvente y soluto-soluto, el proceso de disolución será endotérmico (ΔH disolución > 0).
No hay una correlación clara entre el signo de ΔH disolucion y la variación de la solubilidad con la temperatura. Sin embargo, Mortimer señala que las solubilidades de sustancias que absorben calor cuando se disuelven en soluciones casi saturadas, aumentan con el aumento de la temperatura. La mayoría de los compuestos iónicos se comportan de esta forma. La entalpía de solución de muchos compuestos iónicos en soluciones que son infinitamente diluidas, son exotérmicas. Los mismos compuestos, sin embargo, generalmente se disuelven en soluciones casi saturadas con absorción de energía. Cuando un soluto se disuelve en una solución casi saturada, la entalpía de hidratación es menor que cuando se disuelve en una solución muy diluida.
La variación de la solubilidad se mide mediante una curva de solubilidad, y se realiza a través de la medición de la cantidad de soluto que satura una cantidad de solvente a distintas temperaturas.
Estas curvas hacen posible saber a simple vista si la solubilidad aumenta o disminuye con la temperatura y poder calcular la cantidad de solvente necesaria para disolver completamente una cantidad de soluto a determinada temperatura.
Solubilidad
Solubilidad es la concentración de la disolución saturada a una temperatura determinada. La solubilidad de un soluto sólido en un disolvente determinado suele aumentar al elevar la temperatura, de manera que podremos disolver más cantidad de soluto si aumentamos la temperatura de la mezcla. Por el contrario, cuando se trata de gases, su solubilidad en un disolvente suele aumentar al disminuir la temperatura. También tendremos que decir que disolución es toda mezcla de dos o más sustancias que forman otra sustancia homogénea a nivel molecular.
La cristalización es la técnica de separación de disoluciones en la que las condiciones se ajustan de tal forma que sólo puede cristalizar alguno de los solutos permaneciendo los otros en la disolución. Esta operación se utiliza con frecuencia en la industria para la purificación de las sustancias que, generalmente, se obtienen acompañadas de impurezas. Para que la cristalización fraccionada sea un método de separación apropiado, la sustancia que se va a purificar debe ser mucho más soluble que las impurezas en las condiciones de cristalización, y la cantidad de impurezas debe ser relativamente pequeña.
Solubilidad de los sólidos
La dependencia de la solubilidad de un sólido respecto de la temperatura varía de manera considerable, y dicha variación proporciona una forma para obtener sustancias puras a partir de mezclas. La precipitación selectiva es la separación de una mezcla de sustancias en sus componentes puros con base en sus diferentes solubilidades, pues se puede pasar del punto de saturación en la solución con respecto a uno de los solutos y obligarlo a precipitar, dejando el otro soluto en solución.
Este método funciona mejor si el compuesto que se va a purificar tiene una curva con una fuerte pendiente, es decir, si es mucho más soluble a altas temperaturas que a temperaturas bajas. De otra manera, una gran parte del compuesto permanecerá disuelto a medida que se enfría la disolución. La precipitación selectiva también funciona si la cantidad de impurezas en la disolución es relativamente pequeña.
Durante el desarrollo de la sesión de práctica se quiso obtener la Curva de Solubilidad del Nitrato de Potasio a fin de conocer las condiciones de temperatura y cantidad de solvente necesarias para separar el Nitrato de Potasio de una mezcla, por precipitación selectiva, del otro componente.
Fuente
- Calvet,E: !Química General, Salvat, Barcelona (1962)
- Bailer, Moeller y Kleinberg: Química Básica,Edit Alhambra, Madrd (1968)
- http://apuntes.rincondelvago.com/curvas-de-solubilidad.html Curvas de Solubilidad