Dióxido de Nitrógeno
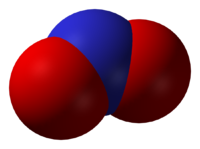
El dióxido de nitrógeno (NO2). es un agente sumamente oxidante, soluble en agua, de color café-rojizo, constituido por un átomo de nitrógeno y dos átomos de oxígeno en su estructura molecular. Constituye uno de los precursores básicos de la neblina o smog fotoquímico y se distingue a simple vista en las grandes urbes por la coloración café-rojizo.
Sumario
Estado natural
Es un compuesto químico de color marrón o amarillo, gaseoso, que se forma como subproducto en la combustión en altas temperaturas, como en motores de vehículos y en plantas industriales. Se forma en la atmósfera por la combinación directa del monóxido de nitrógeno generado en la combustión de los motores y las plantas eléctricas.
Propiedades
- Peso molecular: 46.05 g/mol
- Fase sólida. Punto de fusión: -11.2 °C
- Calor latente de fusión (1,013 bar, en el punto triple): 159.41 kJ/kg
- Fase líquida: Densidad del líquido (1.013 bar en el punto de ebullición): 1443 kg/m3
- Equivalente líquido/Gas (1.013 bar y 21 °C (70 °F)): 424 vol/vol
- Punto de ebullición (1.013 bar): 21.1 °C
- Calor latente de vaporización (1.013 bar en el punto de ebullición) : 430.4 kJ/kg
- Presión de vapor (a 20 °C o 68 °F)&: 1 bar
- Punto Crítico Temperatura Crítica: 157.8 °C
- Presión Crítica: 101.32 bar Fase gaseosa
- Densidad del gas (1.013 bar en el punto de ebullición): 3.4 kg/m3
- Factor de Compresibilidad (Z) (1.013 bar y 15 °C (59 °F)): 0.992
- Gravedad específica (aire = 1) (1.013 bar y 15 °C (59 °F)): 1.59
- Volumen Específico (1.013 bar y 21 °C (70 °F)): 0.512 m3/kg
- Capacidad calorífica a presión constante (Cp) (1.013 bar y 24.3 °C (76 °F)): 0.036 kJ/(mol.K)
- Viscosidad (1.013 bar y 20 °C (68 °F)): 0.000132 Poise
- Conductividad Térmica (1.013 bar y 50 °C (122 °F)): 167.47 mW/(m.K)
Aplicaciones
El dióxido de nitrógeno es un fuerte agente nitrurante u oxidante en la síntesis orgánica. Se utiliza en las mezclas de gases de calibración para la industria petroquímica, en la monitorización de emisiones ambientales, control de higiene industrial, y traza de impurezas en analizadores.
Obtención
La formación de NO2 en la atmósfera resulta de la oxidación del NO generado en los cilindros de los motores de combustión interna por combinación directa de nitrógeno y oxígeno.
La mayor fuente de emisiones de óxidos de nitrógeno es el uso de combustibles fósiles por fuentes fijas y móviles, aunque también se producen óxidos de nitrógeno durante la fabricación de ácido nítrico, el uso de explosivos, uso de gas L.P. y el proceso de soldadura.
Los óxidos de nitrógeno se generan de manera natural por actividad bacterial, volcánica, y por descargas eléctricas atmosféricas; sin embargo, la cantidad generada es baja en comparación con las emisiones de origen antropogénico. La permanencia media del dióxido de nitrógeno en la atmósfera es de un día.
Efectos nocivos
Para el medio ambiente
Es un gas tóxico, irritante y precursor de la formación de partículas de nitrato. Estas llevan a la producción de ácido y elevados niveles de PM-2.5 en el ambiente.
Muchos de los efectos ambientales que se atribuyen al NO2 se deben en realidad a los productos de diversas reacciones asociadas.En presencia de luz solar el NO2 se disocia en NO y O, donde el oxígeno atómico (O) reacciona con el oxígeno molecular del ambiente (O2) para producir ozono (O3), el cual es un contaminante altamente oxidante de efectos conocidos.
Por otra parte el NO2 reacciona con el radical OH para producir partículas de ácido nítrico (HNO3), las cuales se dispersan en el ambiente en forma de lluvia, llovizna, niebla, nieve y rocío, dando origen a un proceso de acidificación de la tierra y cuerpos de agua.
Las variaciones o cambios permanentes en las propiedades de estos elementos, deriva finalmente en la pérdida de hábitat de especies primarias y consecuentemente en catástrofes ecológicas con daños irreversibles.
Para la salud
El dióxido de nitrógeno puede irritar los pulmones, causar bronquitis y pulmonía, así como reducción significativa de la resistencia respiratoria a las infecciones.
Afecta principalmente al sistema respiratorio. La exposición a corto plazo en altos niveles causa daños en las células pulmonares, mientras que la exposición a más largo plazo en niveles bajos de dióxido de nitrógeno puede causar cambios irreversibles en el tejido pulmonar similares a un enfisema.
Los efectos de exposición a corto plazo no son claros, pero la exposición continua o frecuente a concentraciones mayores a las encontradas normalmente en el aire, puede causar un incremento en la incidencia de enfermedades respiratorias en los niños, agravamiento de afecciones en individuos asmáticos y con enfermedades respiratorias crónicas.
A diferencia del ozono, las concentraciones de NO2 en interiores pueden ser más altas que las registradas en el exterior; esto se debe a que una fuente de este contaminante son las estufas que utilizan gas L.P.
Actualmente se acepta que no hay evidencia científica confiable que sugiera la posibilidad de efectos crónicos atribuibles al NO2. Sin embargo, el dióxido de nitrógeno puede ser fatal a concentraciones elevadas.
La OMS recomienda como límite para preservar la salud pública una concentración máxima diaria de 0.11 ppm (ó 200 µg/m³) promedio de 1 hora una vez al año, y 0.023 ppm (ó 40 µg/m³) en una media aritmética anual.
La Norma Oficial Mexicana de NO2 establece como límite de protección a la salud, una concentración máxima diaria de 0.21 ppm (ó 395 µg/m³) promedio de 1 hora una vez al año para protección de la población susceptible.
La concentración de dióxido de nitrógeno en la Ciudad de México, se encuentra por debajo de la norma oficial establecida y la tendencia actual de este contaminante es una reducción de los niveles existentes.
Medidas de seguridad
Entre las medidas que se pueden realizar para proteger la salud se consideran:
- Evitar exponerse al aire libre cuando la condición de calidad del aire sea No satisfactoria
- Realizar ejercicio y otras actividades al aire libre durante el período de horas que este contaminante tiene concentraciones bajas.
- Ingerir abundante agua y alimentos que contienen antioxidantes (frutas y verduras).
- Mantener ventilados nuestros hogares durante el período en que se encuentre encendida la estufa o calentador. Estos constituyen la principal fuente de emisión de NO2 en interiores por combustión de gas L.P. ·
- Antes de realizar cualquier actividad física al aire libre, consulta el índice Metropolitano de la Calidad del Aire de la zona donde vives. El SIMAT realiza mediciones de dióxido de nitrógeno en partes por millón (ppm), esta unidad de medición es utilizada para conocer concentraciones diminutas de elementos presentes por unidad de volumen.
Las técnicas para determinar la concentración de dióxido de nitrógeno son diversas. En la RAMA del SIMAT se realizan mediciones continuas y permanentes con equipo automático que opera con base en las propiedades fisicoquímicas que identifican a cada contaminante.
Los registros de concentraciones de dióxido de nitrógeno se obtienen cada minuto y se procesan como promedios horarios para su disposición al público en forma de Base de Datos. Con esta información se elabora y difunde oportunamente el Índice Metropolitano de la Calidad del Aire para informar a la población sobre las condiciones de calidad del aire.
Véase también
Enlaces externos
Fuentes
- Brown Leyma, "Química de la Ciencia", 7ª Edición, Editorial Prentice Hall, 1998.
- Comisión Nacional de los Derechos Humanos, "La Contaminación Atmosférica en México", Dirección de Publicaciones, México, Agosto 1992.
- Secretaría del Medio Ambiente e Instituto Nacional de Salud Pública. ¿Dónde causa daño? - Respuesta a preguntas sobre contaminación y salud. Fascículo impreso por Grupo Arma S.A. de C.V. México, 1996.
- Organización Mundial de la Salud. Cantú Ramírez Pedro Cesar, "La contaminación ambiental", Editorial Diana, Junio 1993.