Distribución electrónica
| ||||||
Distribución electrónica: Es la distribución de los electrones de un átomo en los diferentes estados energéticos determinados por los orbitales en dicho átomo. Así, mediante la configuración electrónica se representan los diferentes estados de los electrones presentes en el átomo.
Sumario
Distribución electrónica
Como resultado de los grandes esfuerzos realizados por muchos científicos, en la actualidad, la ciencia dispone de múltiples informaciones, comprobadas en la práctica, acerca de las leyes de distribución de los electrones en los átomos, partiendo del modelo de Bohr en la que señalaba la existencia de un núcleo formado por protones y neutrones, donde está concentrada la masa y la carga positiva del átomo. El electrón gira en órbitas circulares alrededor del núcleo, pero con algunas restricciones, como que solamente lo podía hacer en ciertas órbitas, cuya energía se encuentra cuantizada.
Por niveles electrónicos
Asumiendo el modelo de Bohr, los electrones se distribuyen en los átomos formando capas alrededor del núcleo que reciben el nombre de capas electrónicas o también niveles energéticos. Todos ellos forman la envoltura electrónica que rodea al núcleo. Mientras mayor número de capas electrónicas posea un átomo, mayor será la distancia que separa al núcleo de los electrones más externo.
Cada una de las capas electrónicas posee distinto contenido o nivel de energía y se encuentran a diferentes distancias del núcleo, de forma tal que la capa electrónica de menor nivel de energía será la más próxima al núcleo y las de mayores niveles energéticos se encontrarán más alejadas de éste. A medida que los electrones se encuentren en una capa electrónica alejada del núcleo con gran contenido energético estarán más débilmente unidos a éste. .
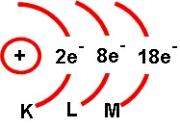
Los diferentes niveles energéticos toman valores enteros a partir de 1; por lo que el valor del primero, o sea, para el que corresponde a la capa más próxima al núcleo es 1, el que corresponde a la segunda capa es 2, etcétera. Estos niveles se representan también, a veces, por las letras K,L,M,N,O,P y Q.
Aunque de acuerdo con la concepción actual del átomo no es posible representarlo gráficamente, desde un punto de vista pedagógico es conveniente tener una representación visual, que, aunque no corresponda exactamente a la realidad, tampoco la contradiga, en la que se utilizan esquemas como el mostrado a continuación:
El núcleo se puede representar con un pequeño círculo donde se señalan tanto protones como indica su número atómico, y tantos neutrones como indica la diferencia entre el índice de masa y el número atómico. La envoltura se puede representar por arcos de circunferencia con centro en el núcleo. Cada arco corresponde a un nivel de energía y en el se coloca un número que indica los electrones que existen en ese nivel.
Se ha podido determinar el número máximo de electrones que pueden agruparse en los distintos niveles de energía y tenemos:
Al analizar bien lo anterior, se observa que cada nivel puede contener un número máximo de electrones igual a 2n2, donde n puede ser 1,2,3, etc., según el nivel energético. Aunque esto no quiere decir que siempre tendrán ese número máximo de electrones. Así, se tendrá que: .
El máximo número de electrones en la penúltima capa es 18 Si la penúltima capa no está completa, el máximo número de electrones en la capa más externa es 2
Particularidades de los electrones de los últimos niveles y la tabla periódica
Puesto que la capa K solo puede alojar dos electrones quedará completa en el gas inerte Helio. Después de este, se va llenando la capa L, con un electrón en el Litio hasta ocho en el Neón, cuya situación es análoga a la del Helio. Con dos en la capa K y ocho en la L quedan ambas capas totalmente ocupadas, mientras que las exteriores a ellas continúan vacías por completo.
El Neón es también un gas inerte, lo que significa que tras un período o ciclo de ocho átomos reaparece la propiedad de la inercia química. En los ocho átomos siguientes, los electrones se adicionan a la tercera capa, M, aumentando gradualmente su número desde el Sodio hasta ocho en el Argón. Cabria suponer que este elemento, número 18 no debería ser un gas inerte, ya que de acuerdo al diagrama de los niveles energéticos la capa M puede admitir hasta diez electrones más, esto es, 18; pero la observación nos dice que el Argón es un gas inerte, y que por tanto, la tercera capa debe considerarse completa cuando contenga ocho electrones.
Desde el punto de vista químico los niveles más externos, y fundamentalmente el último, son los más importantes; pues ellos:
- Permite explicar la recurrencia periódica de los elementos, sus propiedades dependen esencialmente del número de electrones que contiene el nivel energético más externo.
Por ejemplo, en el caso del Litio este posee un electrón en la capa mas externa (nivel L), y lo mismo sucede con el Sodio, aunque se encuentra el electrón en el nivel M. En la tabla periódica los elementos químicos con propiedades semejantes se sitúan uno debajo de otros, lo que equivale a reunir en un grupo aquellos átomos que contienen igual número de electrones en su nivel energético más externo
- Son los electrones que actúan cuando se produce una reacción química.
Por ello con frecuencia los átomos también pueden representar electrónicamente, de un modo simplificado, indicando sólo los electrones del nivel más externo por medio de puntos junto a su símbolo, a esta representación se le llama representación electrónica simplificada o estructura electrónica simplificada. Estas representaciones son llamadas estructuras de Lewis.
Por ejemplo:
El modelo de Bohr no puede ser aplicado a átomos más complejos o a moléculas, manifestado en la distribución electrónica por niveles de energía. Es un modelo semiclásico, porque supone la cuantización de la energía del átomo, pero describe el movimiento del electrón en forma de una trayectoria circular alrededor del núcleo, tal como la física clásica de Newton describe el movimiento de los planetas alrededor del sol y permite calcular la posición de estos en cualquier instante de tiempo.
De la evidencia acumulada del estudio de diversos fenómenos a la escala atómica surgió el convencimiento de que la física de Newton no era aplicable a los electrones y a las demás partículas pequeñas. A partir de ello se plasmó una nueva visión del mundo físico: la mecánica cuántica.
Por la notación nlx
Actualmente para saber a dónde se localizan los electrones en el modelo atómico cuántico se utiliza la configuración electrónica.
Las configuraciones electrónicas de los átomos de los diferentes elementos químicos se expresan convencionalmente en función de los números cuánticos. La manera más útil y empleada de representar la distribución de los electrones en los orbitales de los distintos niveles, es la representada simbólicamente por la notación nlx, donde n representa en forma de número el nivel principal l, el subnivel en forma de letra(s,p,d,f) y x, el número total de electrones en este subnivel. Si todos los niveles electrónicos del átomo se designan de esta forma, la suma de los valores de x debe darnos el número atómico Z.
Reglas para el llenado de los orbitales:
Para acomodar correctamente los electrones en el Modelo Atómico de la Mecánica Cuántica Ondulatoria, existen reglas fundamentales para el llenado de los orbitales:
1.- Principio de exclusión de Pauli afirma que dos electrones no pueden tener en ningún sistema orbital (entiéndase átomo) iguales sus cuatro números cuánticos; en otras palabras, dos electrones pueden tener el mismo conjunto de números cuánticos, si tienen distintos los números que corresponden al espin (sus espines han de estar orientados en sentidos opuestos).
2.- La regla de Hund o de máxima multiplicidad dice que, al llenar orbitales de energía equivalente, los espines de los electrones permanecen desapareados, si es posible; en otras palabras, que el llenado de los orbitales se realiza de tal manera, que el espín resultante sea el máximo.
3.- Principio de Aufbau, de Edificación Progresiva o de Construcción: Los orbitales se llenan según sus energías relativas, empezando por aquellos de menor energía.
Se puede, ahora, deducir las configuraciones electrónicas de los átomos en su estado fundamental sin más que suponer que estos pueden construirse por sucesiva adición de electrones, ocupando estos primeramente los niveles energéticos más bajos disponibles y entrando en los niveles más altos únicamente cuando los más bajos estén llenos. Este es el llamado principio de Aufbau o de construcción, que no es más que el cumplimiento de las reglas planteadas anteriormente.
Existe una regla práctica que nos permite encontrar el orden energético ascendente de los distintos orbitales y que es útil para representar las configuraciones electrónicas a partir del número atómico o carga nuclear.Esta regla se llama regla de las diagonales.
El orden en que van siendo ocupados los orbitales de los distintos subniveles se obtiene siguiendo la dirección de las diagonales de arriba hacia abajo ordenadamente, para ello se debe seguir la flecha del esquema de la derecha, comenzando en 1s; siguiendo la flecha se podrá ir completando los orbitales con los electrones en forma correcta.
Se pueden aplicar las reglas anteriores cuando se representa la distribución electrónica por niveles, subniveles y orbitales a partir del número atómico.
Para graficar la configuración electrónica existen cuatro modalidades, con mayor o menor complejidad de comprensión, que son:
Configuración estándar
Se representa la configuración electrónica considerando la configuración estándar (la que se obtiene del rayado electrónico) . Recordar que los orbitales se van llenando en el orden en que aparecen.
Aplicando el mencionado cuadro de las diagonales la configuración electrónica estándar, para cualquier átomo, es la siguiente:
1s22s22p63s23p64s2 3d10 4p6 5s2 4d1 0 5p6 6s2 4f14 5d10 6p67s2 5f14 6d10
Los valores que se encuentran como superíndices indican la cantidad máxima de electrones que puede haber en cada subnivel (colocando sólo dos en cada orbital de los subniveles).
Configuración condensada
Los niveles que aparecen llenos en la configuración estándar , se pueden representar con un gas noble (elemento del grupo VIII A ) , donde el número atómico del gas , coincida con el número de electrones que llenaron el último nivel. Los gases nobles son (He , Ne, Ar , Kr , Xe y Rn ).
Configuración desarrollada
Consiste en representar todos los electrones de un átomo , empleando flechas para simbolizar el spin de cada unos. El llenado se realiza respetando el principio de exclusión de Pauli y la Regla de máxima multiplicidad de Hund
Configuración semidesarrollada
Esta representación es una combinación entre la configuración condensada y la configuración desarrollada . Aquí solo se representan los electrones del último nivel de energía.
La representación de las 4 configuraciones para el 24 Cr , son :
Para determinar la configuración electrónica de un elemento sólo hay que saber cuántos electrones debemos acomodar y distribuir en los subniveles empezando con los de menor energía e ir llenando hasta que todos los electrones estén ubicados donde les corresponde. Recordemos que partiendo desde el subnivel s, hacia p, d o f se aumenta el nivel de energía.
En cada subnivel hay un número determinado de orbitales que pueden contener, como máximo, 2 electrones cada uno. Así, hay 1 orbital tipo s, 3 orbitales p, 5 orbitales d y 7 del tipo f. De esta forma el número máximo de electrones que admite cada subnivel es: 2 en el s; 6 en el p (2 electrones x 3 orbitales); 10 en el d (2 x 5); 14 en el f (2 x 7).
Entendido el tema de las capas, y sabiendo que cada una de ellas representa un nivel de energía en el átomo, diremos que:
Ambas distribuciones
1. Existen 7 niveles de energía o capas donde pueden situarse los electrones para girar alrededor del núcleo, numerados del 1, el más interno o más cercano al núcleo (el que tiene menor nivel de energía), al 7, el más externo o más alejado del núcleo (el que tiene mayor nivel de energía).
Estos niveles de energía corresponden al número cuántico principal (n) y además de numerarlos de 1 a 7, también se usan letras para denominarlos, partiendo con la K. Así: K =1, L = 2, M = 3, N = 4, O = 5, P = 6, Q = 7.
2. A su vez, cada nivel de energía o capa tiene sus electrones repartidos en distintos subniveles, que pueden ser de cuatro tipos: s, p, d, f.
Para determinar la configuración electrónica de un elemento sólo hay que saber cuantos electrones debemos acomodar y distribuir en los subniveles empezando con los de menor energía e ir llenando hasta que todos los electrones estén ubicados donde les corresponde. Recordemos que partiendo desde el subnivel s, hacia p, d o f se aumenta el nivel de energía.
3. En cada subnivel hay un número determinado de orbitales que pueden contener, como máximo, 2 electrones cada uno. Así, hay 1 orbital tipo s, 3 orbitales p, 5 orbitales d y 7 del tipo f. De esta forma el número máximo de electrones que admite cada subnivel es: 2 en el s; 6 en el p (2 electrones x 3 orbitales); 10 en el d (2 x 5); 14 en el f (2 x 7)
La distribución de niveles, subniveles, orbitales y número de electrones posibles en ellos se resume, para las 4 primera capas, en la siguiente tabla:
| Niveles de energía o capa (n) | 1 (K) | 2 (L) | 3 (M) | 4 (N) |
|---|---|---|---|---|
La configuración electrónica de un átomo es la distribución de sus electrones en los distintos niveles, subniveles y orbitales. Los electrones se van situando en los diferentes niveles y subniveles por orden de energía creciente (partiendo desde el más cercano al núcleo) hasta completarlos.
La distribución electrónica y su relación con la tabla periódica
En la tabla periódica, entre los datos que encontramos de cada uno de los elementos se hallan el Número atómico y la Estructura electrónica o Distribución de electrones en niveles.
El Número atómico nos indica la cantidad de electrones y de protones que tiene un elemento.
La estructura electrónica o distribución de electrones en niveles indica cómo se distribuyen los electrones en los distintos niveles de energía de un átomo o de un ion.
Para escribir la configuración electrónica es necesario:
1.- Conocer su número atómico (sacado de la tabla periódica).
2.- La carga (del átomo o del ión) está dada por número de protones menos (–) número de electrones.
3.- El número de protones es igual al número atómico del elemento (átomo o ión).
4.- En cada átomo hay (en estado eléctrico neutro) igual número de protones que de electrones.
5.- Ubicar los electrones en cada uno de los niveles de energía, comenzando desde el nivel más cercano al núcleo (nivel 1). Respetar la capacidad máxima de cada subnivel (s = 2e-, p = 6e-, d = 10e- y f = 14e-).
Supongamos que se quiere averiguar la distribución electrónica
De un elemento quimico
En este caso el elemento sodio, que como su número atómico indica tiene 11 electrones, los pasos son muy sencillos: seguir la regla de las diagonales, comenzando por
1s22s22p63s2
Siempre se debe ir sumando los superíndices, que indican la cantidad de electrones, obteniendo 12, quiere decir que existe un electrón de más, ya que la suma para ser correcta debe dar 11, por lo que al final se debería corregir para que quedara 3s1.
Por lo tanto, para el sodio (11 electrones), el resultado es: 1s22s22p63s1
Primer nivel:
2 electrones (los 2 en subnivel s, en un orbital);
Segundo nivel:
8 electrones (2 en subnivel s, en un orbital, y 6 en subnivel p, con 2 en cada uno de sus 3 orbitales);
tercer nivel:
1 electrón (ubicado en el subnivel s, en un orbital).
De un ion
Por ejemplo, el ión Mg+2 (magnesio más dos), averiguamos o sabemos que su número atómico (Z) es 12, significa que tiene 12 protones y debería tener 12 electrones, pero como el ión de nuestro ejemplo (Mg+2) tiene carga +2 (porque perdió o cedió 2 electrones), hacemos
12 (protones) – X = 2
Por lo tanto X (número de electrones del ión Mg+2) es igual a 10,
El ión Mg+2tiene 10 electrones.
¿Cómo se determina su configuración electrónica o lo que es lo mismo cómo se distribuyen esos electrones en los orbitales del átomo?
Se comienza por el nivel inferior (el más cercano al núcleo): 1, que sólo tiene un orbital s, y sabemos que cada orbital tiene como máximo 2 electrones (1s2).
Se pasa al segundo nivel, el 2, en el cual encontramos orbitales s (uno) y orbitales p (tres) (2s y 2p 2p 2p).
En 2s hay sólo 2 electrones: 2s2 y en cada 2p hay dos electrones: 1s2 2s2 2p6 (este 2p6es los mismo que 2p2 + 2p2 + 2p2= 2p6)
De modo inverso:
si tenemos o conocemos la configuración electrónica de un elemento podemos predecir exactamente el número atómico, el grupo y el período en que se encuentra el elemento en la tabla periódica.
Por ejemplo, si la configuración electrónica de un elemento es 1s22s22p63s23p5, podemos hacer el siguiente análisis:
Para un átomo la suma total de los electrones es igual al número de protones; es decir, corresponde a su número atómico, que en este caso es 17. El período en que se ubica el elemento está dado por el máximo nivel energético de la configuración, en este caso corresponde al período 3, y elgrupo está dado por la suma de los electrones en los subniveles s y p del último nivel; es decir, corresponde al grupo 7.
Propiedades derivadas de la estructura electrónica
De la estructura electrónica depende el comportamiento químico de los elementos, que está estrechamente relacionado con las siguientes propiedades:
Enlace químico.
Formación de iones.
Carácter electroquímico.
Electroafinidad
Energía de ionización
Referencias
- Fernández, D. y otros: Química General Parte II. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1984.
- Lara Piñeiro. A.R. E. Calero Martín y J. Labadié Suárez: Materiales Complementarios de Química para Ingenieros. Ed. Pueblo y Educación. . Ciudad de La Habana, Cuba. 1987.
- León Ramírez, R.: Química General. Ed. Pueblo y Educación. . Ciudad de La Habana, Cuba. 1985.
- Sánchez Varona, O. y otros: Química Cuarto curso SOC. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1982.
- Sienko,J. y R. A.Plane: Química. Ed. Selecciones gráficas. Madrid, España. 1972.
Fuentes
Enlace relacionado