Guanina (bioquímica)
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
La guanina es una de las cuatro bases nucleares principales encontradas en los ácidos nucleicos del ADN y el ARN, los otros son la adenina, la citosina y la timina.
En el ADN la guanina se empareja con la citosina.
El nucleósido de la guanina se llama guanosina.
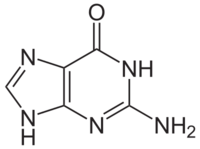
Con la fórmula C5H5N5O, la guanina es un derivado de la purina, consistiendo en un sistema fundido de la pirimidinaimidazol del anillo con los enlaces dobles conjugados. Siendo insaturados, la molécula bicíclica es planar. El nucleósido de guanina, enlazado con un azúcar de cinco carbonos, se llama guanosina y carece solamente de un fosfato para formar un nucleótido. En el ADN, la guanina y la adenina forman enlaces del hidrógeno con sus derivados complementarios de la pirimidina, citosina y timina. En el ARN el complemento de la adenina es el uracilo en vez de timina. Así, la guanina, junto con la adenina y la citosina, está presente en la DNA y el RNA, mientras que la timina está solamente en el ADN, y el uracilo solamente en ARN.
La ubicuidad de la guanina, que desempeña un papel central en el ADN de todos los organismos vivos e incluso en los virus ARN, evidencia de la conexión de toda vida.
La guanina tiene dos formas tautoméricas, la forma mayor de Keto y la forma rara de Enol. Se une a la citosina a través de tres enlaces de hidrógeno. En citosina, el grupo amino actúa como el donante de bonos de hidrógeno y el c-2 carbonilo y la amina n-3 como los aceptadores de bonos de hidrógeno. La guanina tiene el grupo del carbonilo c-6 que actúa como el aceptador del enlace del hidrógeno, mientras que un grupo en n-1 y el grupo amino en c-2 actúan como los donantes del enlace del hidrógeno.
La guanina se puede hidrolizar con el ácido fuerte a la glicina, al amoníaco, al dióxido de carbono, y al monóxido de carbono. Primero se convierte en xantina. La guanina oxida más fácilmente que la adenina. Su alto punto de fusión de 350° refleja la unión de hidrógeno intermolecular entre los grupos oxo y amino en las moléculas del cristal. Debido a esta vinculación intermolecular es relativamente insoluble en el agua, pero es soluble en ácidos diluidos y bases.
El código genético se representa con la letra G. Es un derivado púrico con un grupo oxo en la posición 6 y un grupo amino en la posición 2. Forma el nucleósido (desoxi)guanosina y el nucleótido guanilato o (desoxi)guanosina monofosfato (dGMP, GMP). La guanina siempre se empareja en el ADN con la citosina de la cadena complementaria mediante tres enlaces de hidrógeno, G≡C. Su fórmula química es C5H5N5O y su nomenclatura 6-oxo, 2-aminopurina.
También existen otras bases nitrogenadas (las llamadas bases nitrogenadas minoritarias), derivadas de forma natural o sintética de alguna otra base mayoritaria. Lo son por ejemplo la hipoxantina, relativamente abundante en el tRNA, o la cafeína, ambas derivadas de la adenina; otras, como el aciclovir, derivadas de la guanina, son análogos sintéticos usados en terapia antiviral; otras, como una de las derivadas del uracilo, son antitumorales.
Las bases nitrogenadas tienen una serie de características que les confieren unas propiedades determinadas. Una característica importante es su carácter aromático, consecuencia de la presencia en el anillo de dobles enlaces en posición conjugada. Ello les confiere la capacidad de absorber luz en la zona ultravioleta del espectro de frecuencias en torno a los 260 nanómetro, lo cual puede aprovecharse para determinar el ley de Beer-Lambert del ADN y hallar la concentración existente de los ácidos nucleicos.
Otra de sus características es que presentan tautomería o isomería de grupos funcionales, debido a que un átomo de hidrógeno unido a otro átomo puede migrar a una posición vecina; en las bases nitrogenadas se dan dos tipos de tautomerías: tautomería lactama-lactima, donde el hidrógeno migra del nitrógeno al oxígeno del grupo oxo (forma lactama) y viceversa (forma lactima), y tautomería imina-amina primaria, donde el hidrógeno puede estar formando el grupo amina (forma amina primaria) o migrar al nitrógeno adyacente (forma imina).
La adenina sólo puede presentar tautomería amina-imina, la timina y el uracilo muestran tautomería doble lactama-lactima, y la guanina y citosina pueden presentar ambas.
Por otro lado, y aunque se trate de moléculas apolares, las bases nitrogenadas presentan suficiente carácter polar como para establecer puentes de hidrógeno, ya que tienen átomos muy electronegativos (nitrógeno y oxígeno) que presentan carga parcial negativa, y átomos de hidrógeno con carga parcial positiva, de manera que se forman dipolos que permiten que se formen estos puente de hidrógeno.
Se estima que el genoma humano haploide tiene alrededor de 3000 millones de pares de bases. Para indicar el tamaño de las moléculas de ADN se indica el número de pares de bases, y como derivados hay dos unidades de medida muy utilizadas, la kilobase (kb), que equivale a 1000 pares de bases, y la megabase (Mb), que equivale a un millón de pares de bases.