Herpes virus (Clasificación)
| ||||||||||
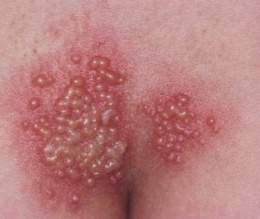
La familia de los herpes virus tiene 8 grupos según estructura del virión, produciendo diferentes enfermedades o manifestaciones clínicas, donde el más frecuente es el Virus Herpes Simple (VHS) Tipo 1 (VHS-1) y Tipo 2 (VHS-2), que es una Infección de Transmisión Sexual (ITS) altamente contagiosa; pero que otros virus de esta familia producen enfermedades importantes también como el Herpes zoster, la Varicela, Exantema súbito en los niños entre otras.
Sumario
Clasificación
Virus del herpes (Familia)
Enfermedades asociadas al virus herpes de acuerdo con su familia:
Virus herpes simple tipo-1 (VHS)
- Gingivoestomatitis herpética
- [Panadizo] herpético
- Lesiones cutáneas
- Eczema herpético
- Keratoconjuntivitis herpética
- Herpes labial
- Encefalitis herpética
Virus herpes simple tipo 2 (VHS-2)
Virus varicela/zoster (VVZ)
- Varicela
- Herpes zoster
- Neuralgia posherpética
- Síndrome de Reye
Virus citomegálico (VCM)
- Infección del recién nacido
- Mononucleosis con anticuerpos heterófilos negativos
Virus Epstein-Barr (VEB)
- [Mononucleosis infecciosa]
- Carcinoma nasofaríngeo
- [Linfomas de Burkitt's]
- Linfomas de las células B
Virus Herpes 6 (VH-6)
- [Exantema súbito] *Síndrome febril asociado a las convulsiones o no *[Meningoencefalitis]
Virus Herpes 7 (VH-7)
- Exantema súbito *Pitiriasis rosea
Virus herpes 8 (VH-8)
- [Sarcoma de Kaposi]
- Linfoma de cavidades
- [Enfermedad de Castelman]
La clasificación en 8 grupos ha sido realizada por diferencias en la arquitectura del virión y la composición del genoma. Todos los virus herpes humanos son ubicuos, transmitidos por contacto directo y se manifiestan por una infección primaria, una infección latente que sigue a la primaria, seguida de una reactivación localizada con inmunidad celular intacta.
Los virus herpes son adquiridos durante la niñez y, en menor grado, durante los inicios de la adolescencia. La seropositividad se relaciona con el aumento de la edad y estado socioeconómico bajo. La transmisión aumenta cuando se incrementan las condiciones de hacinamiento.
Todos los virus herpes han sido detectados en la saliva en algún estadio de la infección. Las manifestaciones clínicas son diversas, como lo es también su sitio de latencia. Los VHS tipo 1 y 2 tienen su período de latencia localizado en los ganglios sensoriales. Los VEB, VH 6 y 7 infectan y persisten en los linfocitos. El VCM tiene una afinidad por las células mononucleares, células endoteliales y es menor en los tejidos de las glándulas salivares.
La inmunidad mediada por células juega un papel crítico en la recuperación de la infección por el virus herpes y puede, a su vez, establecer un papel en el desarrollo de las recurrencias.
Muchas personas que están infectadas con el VHS no presentan ninguna señal ni ningún síntoma. Por ejemplo, las mujeres con infección en el cuello del útero pueden tener muy pocos o ningún síntoma. Pero cuando los síntomas se presentan —lo cual se conoce como un brote— el herpes genital causa vesículas dolorosas en los muslos, genitales o en el recto las cuales se revientan y se convierten en ulceraciones.
Herpes virus menos conocidos
Virus del herpes 6-7-8
En 1986, un nuevo virus fue aislado en 6 pacientes con síndrome linfoproliferativo, dos de ellos también infectados por el VIH. Los estudios moleculares, estructurales y serológicos confirmaron la presencia de un nuevo virus de la familia de los virus herpes. Se le asignó el nombre de herpes virus 6; es el primer virus del grupo herpes aislado y descubierto en los últimos 20 años. Cuatro años después, otro virus novel designado VH 7 fue aislado de los linfocitos CD4+ de un adulto sano. En 1994, se identificó el ADN del 8vo. Miembro de la familia de los virus herpes en las lesiones de un sarcoma de Kaposi en un paciente infectado por el VIH.
Herpes virus 6
Con el aislamiento del herpes virus 6 en pacientes con SIDA, se iniciaron las investigaciones con el objetivo de identificar posibles enfermedades asociadas. En 1988, se describe el VH 6 como el agente causal del exantema súbito (Roseola infantum).
Causa
Basado en el análisis genético de la glicoproteína estructural gH, los virus herpes se dividen en 3 subfamilias: α, ß, γ El análisis genómico coloca al VH 6 entre los ß virus, en compañía del virus herpes 7 y el VCM. Se conocen dos variantes del virus, la variante A y la variante B. Casi todas las infecciones primarias en los niños son causadas por la variante B. La secuencia de los aminoácidos sugiere una homología con el VCM en el 76 %. Está mucho más relacionada con el VH 7 aunque son antigénicamente distintos. El VH 6 tiene un tropismo predominante con los linfocitos CD4 y los NK.
Ultraestructura
Como todo virus del grupo herpes virus se compone de 3 elementos estructurales:
- Tiene una nucleocapsida con simetría icosahedral y un diámetro de 90 a 110 nm que contiene el ADN genómico.
- Una envoltura en la cual están las glicoproteínas virales.
- El tegumento que consiste en una mezcla de proteínas que ocupan el espacio entre la nucleocapsida y la envoltura del virus.
El virion maduro tiene aproximadamente 200 nm de diámetro. El genoma del HVS 6 es ADN lineal, de doble cadena de 162 kb de tamaño con una región U flanqueada por las terminales repetidas (LTR) interrumpidas por 3 intermedios repetidos: R1-R2- y R3 en la región A inmediata.
Replicación
Ambas variantes del virus (A-B) entran en la célula por intermedio del receptor CD46 que está presente en la membrana de todas las células nucleadas, fisiológicamente relacionado con la regulación del complemento. Esta glicoproteína también actúa como receptor de la vacuna del sarampión.
Para su entrada, el virus utiliza sus glicoproteínas gp H, gp L y la gp 0. Después de esta unión con el receptor mediante la fusión de ambas membranas, la nucleocapsida es transportada a través del citoplasma al poro nuclear donde el genoma del ADN viral es liberado dentro del núcleo plasma. Entonces, el virus usa la maquinaria de la transcripción y la traslación celular para producir 3 clases de proteínas cinéticas (IE, E y L) que regulan la expresión de otros genes que regulan la replicación. El ciclo de replicación (nuevo virión) dura 72h.
Epidemiolgía
La infección primaria ocurre precozmente en la vida. Más del 90 % de los recién nacidos son seropositivos al VH-6, lo que refleja la transmisión materno fetal de los anticuerpos maternos; entre los 4 y 6 meses la prevalencia disminuye significativamente entre 0 y 60 %. A la edad de 12 meses del 60 al 90 % de los niños poseen anticuerpos al VH-6 y entre los 3 a 5 años el 80 al 100 % son seropositivos. El pico de la infección por el VH-6 a los 6 a 15 meses se corresponde con el pico de la adquisición del ES. Menos de la mitad de las infecciones por el VH-6 presentan en Estados Unidos formas sintomáticas del ES, mientras que en Japón lo hacen en el 80 %. La infección por el HV-7 ocurre un poco más tarde, del 45 al 75 % infectan a los 2 años y el 90 % entre los 7 y 10 años.
Los brotes infecciosos son poco comunes y contrario a lo que ocurre con otras infecciones exantemáticas, no hay el antecedente de contacto con otros casos. Los adultos eliminan ambos virus por la saliva y la orina y pueden infectar a los niños. Las mujeres pueden eliminar bajo rate los HV-6 y HV-7, pero la transmisión sexual no ha sido demostrada. Hay evidencias de transmisión en el útero del HV-6, pero son casos muy raros y no están reportadas malformaciones. No han sido descritas infecciones congénitas con el VH-7. El VH-6 puede transmitirse por medio de transplantes de médula ósea o de órganos sólidos. No hay evidencias de transmisión por la lactancia materna o las transfusiones de sangre.
Los seres humanos son los únicos hospederos naturales conocidos. La transmisión ocurre por la eliminación del virus persistentemente de las secreciones nasales y sobre todo por la saliva de los miembros de la familia (madre-niño, niño a niño) y otros contactos íntimos. Durante la fase febril de la infección primaria, el virus puede ser aislado de los linfocitos, en la saliva y en el líquido cefalorraquídeo. El ADN del virus VH-6 puede ser detectado por medio del test del PCR en el 90 % de la saliva de individuos sanos. El ADN del virus ha sido identificado también en el aparato genital de las mujeres grávidas o no, en el 10 al 20 % y en el tejido fetal pudiendo ser causa de aborto. El período de incubación es de 9 a 10 días (rango 5-15).
Patogenia
Poco se conoce de la patogenia de la infección por el VH-6. El virus probablemente se adquiere de la saliva de personas sanas y penetra en el hospedero a través de las mucosas oral, nasal y de la conjuntiva. Después de la replicación viral en un sito desconocido, se produce una viremia de gran carga en las células mononucleares en la sangre periférica. A continuación de la infección aguda se establece un período de latencia en estas células y posiblemente en las glándulas salivares, riñón, pulmón y el SNC. Ambos virus tienen la facultad de evadir al sistema inmune disminuyendo la regulación de la respuesta del CHM-tipo-1
El VH-6 puede suprimir todas las líneas celulares en la médula ósea y la infección activa está asociada con una supresión medular en los pacientes con transplantes de médula ósea.
El HV-6 tiene efectos significativos en el sistema inmune como son: estímulo de la actividad de las células NK, supresión de la proliferación de las células mononucleares, e inducción de una respuesta proinflamatoria de las citoquinas. La persistencia del virus después de la infección primaria se ha probado por estudios en pacientes transplantados al igual que en adultos sanos.
Manifestaciones clínicas
Niños. La primera enfermedad en la que se aisló el ADN del VH-6 como agente causal fue el exantema súbito. Esta enfermedad fue descrita en 1910 por Zahorsky y la llamó roseola infantum y en 1921 se le dio el nombre de exantema súbito. Se caracteriza por presentar fiebre alta, constante o intermitente de 39 a 400C durante 3 a 5 días en un niño que aparentemente está sano. En algunos casos aparecen síntomas ligeros de infección respiratoria superior con otitis media o sin ella.La fiebre desaparece en crisis o en lisis rápida y a las 24h aparece el exantema de forma maculopapulosa intensamente rosado, con predominio en el cuello y tronco, aunque a veces se presenta también en las extremidades, en la cara y en las regiones retroauriculares. El rash no es pruriginoso, no descama y desaparece después de 24 a 48h. La variante B del virus es la responsable en la mayoría de los casos. En los países asiáticos se ha identificado la presencia de úlceras en la unión uvulopalatoglosal y se conoce como spot de Nagayama. Existen presentaciones atípicas de la enfermedad como serían:
- Exantema súbito sin fiebre.
- Exantema súbito sin rash.
- Exantema súbito del joven.
Otra forma clínica frecuente es el síndrome febril asociado con otitis media o no. El VH-6 está presente en el 20 % de las visitas a los departamentos de urgencias de los hospitales pediátricos por síndrome febril en los niños de 6 meses a 1 año con síntomas de localización o no. El 13 % requiere hospitalización por presentar convulsiones prolongadas o recurrentes de aparición tardía. El VH-6 está presente en el 30 % de las convulsiones febriles en los menores de 2 años. Las manifestaciones neurológicas que pueden presentarse durante la infección incluyen: fontanela abombada, irritabilidad, convulsiones, meningitis aséptica, encefalitis y convulsiones.
Adultos. La infección es rara, pues la mayoría de los niños la adquieren precozmente en la niñez. Cuando ocurre, se manifiesta por adenopatías, un síndrome parecido a la mononucleosis y a veces, hepatitis. Este virus últimamente ha sido implicado en la causa de dos entidades raras: la linfadenitis histiocítica necrotizante (enfermedad de Kikuchi) y la histiocitosis con linfoadenopatías gigantes (enfermedad de Rosai-Dorfan), esta última con buena respuesta al tratamiento con acyclovir. El verdadero papel de este virus en la causa de estas dos infecciones aún tiene que ser determinado.
Infección en pacientes transplantados. La reactivación del virus se puede presentar entre la 2da. semana y los 3 meses después del transplante. Ha sido bien estudiado en los transplantes de riñón y médula ósea y en menor grado en los hepáticos. Se reporta que estas reactivaciones son más frecuentes en los transplantes de células madres. Las enfermedades asociadas con la reactivación han sido descritas en los hospederos inmunocomprometidos con hepatitis, neumonía, supresión de médula ósea y encefalitis. La coinfección de ambos virus VH-6 y VH-7 con el CMVpuede aumentar las enfermedades asociadas al CMV en los transplantados.
El VH-6 como cofactor en la progresión de la infección por el VIH. Varias investigaciones han sugerido que el VH-6 juega un papel como cofactor en la progresión de la infección por el VIH, pues tienen el mismo tropismo por el receptor CD4+ mientras que otros no han encontrado esta asociación. Estos estudios han sido realizados en adultos, lo que complica la interpretación.
Como el VH-6 presenta un período de latencia después de la infección primaria en los niños, es difícil evaluar la posible interacción entre el VIH y el VH-6, pues resulta difícil determinar si la reactivación del VH-6 produce una progresión del VIH o la progresión del VIH con la consiguiente declinación de la inmunidad, produce la reactivación del VH-6.
También el análisis del VH-6 como factor de progresión ha sido limitado por la presencia de otros virus como el VCM y el VEB considerados también como posibles cofactores.
Diagnóstico
El diagnóstico de la infección se realiza por métodos clínicos, serológicos y virológicos. Como sucede con otras infecciones producidas por la familia de los virus herpes en los cuales se presenta un período de latencia, el diagnóstico de la infección primaria es más fácil que en el período de reactivación.
En general, un aumento de 4 veces o más de los valores iniciales en los títulos de anticuerpos entre la fase aguda y la fase de convaleciente, sugiere que la reactivación activa viral se ha establecido. La seroconversión de los anticuerpos serológicos colectados en la 2da. y 3ra. semanas puede establecer el diagnóstico de la infección activa, pero no discrimina entre primaria y reactivación del VH-6. La dosificación de la IgM en los lactantes y niños mayores es un marcador de infección primaria, pero ningún método ha sido evaluado, por lo que no se recomienda. Es importante señalar que los anticuerpos del CMV tienen reacción cruzada con los HV-6 y HV-7, por lo que el diagnóstico serológico requiere de la exclusión de la infección por el CMV.
También el cultivo de virus identifica la infección activa por el VH-6. El mismo valor tienen los estudios del ADN viral por el test del PCR. La identificación de los virus HV-6 y HV-7 en los cultivos de células mononucleares establece el diagnóstico positivo de la infección primaria aguda en los pacientes inmunocompetentes, no así en los no competentes donde es más problemático por la pobre carga viral.
Este test tiene la desventaja de requerir de la incubación de las células por días o semanas. El test de la detección del virus por el PCR, cuando se usan muestras acelulares (suero o LCR) indica infección activa, sin embargo, en muestras celulares: células mononucleares, saliva o tejidos, no necesariamente indica infección activa, pues el VH-6 existe en forma latente en muchos tejidos después de la infección primaria.
Prevención y tratamiento
Dada la ubicuidad de la infección por el VH-6 en los 3 primeros años de vida y la falta de una vacuna efectiva, la prevención primaria no es posible, sin embargo, la prevención de la reinfección es posible con los medicamentos antivirales. Esta posibilidad ha sido el resultado de investigaciones recientes con el empleo profiláctico del acyclovir en los pacientes transplantados. Se requieren más investigaciones para recomendar este medicamento como tratamiento preventivo.
La multiplicación del VH-6 es rápidamente inhibida por el ganciclovir, cidofovir, y el foscarnet. El VH-7 es inhibido por cidofovir y el foscarnet.
Estos medicamentos deben ser utilizados cuando se presenten complicaciones en el SNC, hepatitis o neumonitis. También en las formas severas que se presentan en los pacientes inmunocomprometidos.
Virus herpes-7
En 1990, Frenkel descubrió un nuevo virus del grupo herpes durante sus investigaciones con el VH-6. Aunque mucho se conoce de la biología del VH-7 ninguna enfermedad ha sido identificada con seguridad como producida por el VH-7. El CD4+ de los linfocitos T ha sido identificado como su receptor.
Causa
El VH-7 es un miembro de la subfamília de los betavirusherpes estrechamente relacionado con el VIC y el VH-6. Pertenece a la familia de los Herpesviridae formados por una cadena larga y doble de ADN genómico.
Epidemilogía
La infección primaria por el VH-7 se presenta en los primeros 5 años de vida, algo posterior a la infección por el VH-6.
Transmisión
Aunque el reservorio mayor del VH-7 permanece ignorado, se sugiere que las glándulas salivares pueden ser el sitio de la replicación del virus y de su transmisión. Estudios realizados en Alemania en donantes de sangre detectaron el virus por medio del test del PCR en el 95 % de las muestras de saliva y en el 66,1 % de la sangre. El virus también ha sido identificado en las mujeres embarazadas aumentando las posibilidades de transmisión intraútero y perinatal. La infección persiste durante toda la vida.
Al igual que el VH-6, el VH-7 se transmite en los niños muy pequeños, posiblemente por el contacto con las secreciones respiratorias infectadas de personas sanas.
En adultos, el 85 % o más tienen pruebas serológicas de infección por el virus. El período de incubación se desconoce.
Manifestaciones clínicas
La mayoría de las infecciones son asintomáticas. El VH-7 no tiene asignada una enfermedad específica. Algunos datos señalan la asociación de este virus con los primeros o segundos episodios del exantema súbito. También ha sido asociado con las convulsiones febriles.
Este virus ha sido aislado en las infecciones menores del aparato respiratorio y en pacientes con síndrome febril asociado a hepatoesplenomegalia y pancitopenia asociado con el síndrome hemofagocítico. Han sido reportadas interacciones entre el VH-6 y el VH-7.
El VH-7 puede competir con el VIH por el receptor CD4+ de los linfocitos T con el VIH disminuyendo su infectividad. Este fenómeno está siendo explorado como una posible vía para intervenir en la progresión de la infección por el VIH. Recientemente, se ha considerado que este virus es el agente causal de la Ptiriasis rosea.
Virus herpes- 8
La identificación de este nuevo herpes virus humano (HV-8) también conocido como virus asociado al sarcoma de Kaposi (SK) fue realizado en 1994 por Yuan Chang en sus estudios en pacientes con SIDA complicados con SK estudiando las secuencias del ADN. Es uno de los pocos virus que está asociado con la génesis de rumores en los humanos.
Causa
El HV-8 es un miembro de los herpes virus γ, que también incluye el EBV. Es un virus ADN con aproximadamente 165 kb y con una estructura genómica típica de los otros herpes virus. Varias proteínas imitan a los genes celulares humanos relacionados con la regulación del crecimiento celular, y se postula que estas contribuyen al desarrollo de la malignidad. La proteína Tat del VIH actúa como un factor angiogénico y como un estimulador de la replicación del HVSK. Por lo tanto, el paciente VIHpositivo tiene un alto riesgo de desarrollar el SK no solo por la inmunodeficiencia celular sino también por interacciones específicas entre el virus y las proteínas.
Epidemiología
Están descritas 4 variantes epidemiológicas y clínicas: clásica, endémica (africana), asociada a los transplantes (iatrogénica) y la epidémica, asociada al SIDA.
La forma clásica ocurre preferentemente en las personas de edad en el Mediterráneo o en Europa del Este, de evolución lenta, a veces transcurren décadas en las que se localizan primariamente en la piel. La forma endémica es el tumor más frecuente en los hombres en África Central, que desde la llegada del SIDA se ha hecho común en ambos sexos en una proporción hombre-mujer de 19,1 a 1,7 a 1 especialmente en el Este.
Adopta una forma similar al clásico SK en adultos VIHnegativos, afecta a los niños a veces en una forma linfoadenopática progresiva que es fatal. La forma iatrogénica es mayormente producida por una reactivación de la infección, sin embargo, la transmisión del virus por el órgano transplantado puede ocurrir. La forma asociada al SIDA es la forma de SK más prevalente. Afecta a los homosexuales (50 % de riesgo antes de la aparición del TARSA). Estos pacientes presentan formas más diseminadas: cutáneas, linfáticas con invasión de la boca desarrollando en ocasiones diseminación visceral fatal. Esta severidad del SK en el SIDA está relacionado con la carga viral y está inversamente relacionada con el conteo de CD4+.
En general, la incidencia de SK en los pacientes con SIDA ha disminuido notablemente después del empleo del TRASA. Esta infección es rara en los niños y adultos sanos en muchos países desarrollados, sin embargo, ha sido reportado en el 5 al 19 % de los adultos en algunas regiones de Grecia e Italia y en el 30 al 60 % de los adultos en África central y este. El virus está presente en la tercera parte de los homosexuales varones con SIDA y en el 80 % de los casos de SIDA asociados al SK.
Las manifestaciones clínicas de la infección aguda del HV-8 se desconocen y el período de incubación no está establecido. El VH-8 puede ser aislado hasta 6 años anteriores al inicio del SK. Contrariamente de los otros herpes virus el HVSK no es ubicuo. Los porcentajes de seropositivos varían de acuerdo con la raza y las variaciones geográficas. Menos del 3 % en Estados Unidos y muchos países europeos hasta 25 % en los países del Mediterráneo, a 50 % en Uganda y otros países del África central.
Vías de transmisión
La transmisión sexual del HVSK está bien establecida, particularmente en los contactos homosexuales. La prevalencia de la infección está asociada con el número de contactos y se correlaciona con una historia de enfermedades de transmisión sexual. Los factores de riesgo de la transmisión heterosexual son menos claros.
La transmisión horizontal madre-hijo, la saliva y otras vías de transmisión no conocidas han sido sugeridas.
Una eliminación del virus por la saliva ha sido reportada, y en los queratinocitos está presente el virus y se replica, esto pudiera indicar que las células epiteliales en las mucosas sea un sitio primario de la infección. El SK familiar es extremadamente raro, no obstante, la transmisión intrafamiliar se ha sugerido y los familiares de pacientes con SK tienen un riesgo 3 veces mayor de seroprevalencia que la población normal.
Aunque el HVSK puede probablemente ser transmitido por el transplante de órganos, no hay evidencias de transmisión por medio de las transfusiones de sangre.
Mecanismos oncogénicos. El VHSK junto con el virus humano de las células T linfotrópico, el virus de la hepatitis B y el de la hepatitis C, el papiloma virus y el virus del Epstein-Barr, son capaces de inducir tumores malignos en humanos. Al igual que otros virus oncogénicos, el VHSK está relacionado con varios mecanismos para inmortalizar y transformar las células. En su genoma viral contiene varios genes que son homólogos a los protooncogenes, capaces de inducir tumores malignos.
Diagnóstico
El primer test diagnóstico para la identificación del VHSH se basa en el empleo de PCR para amplificar el ADN viral. Este ADN está presente en casi todas las lesiones del SK.
Los test serológicos se usan en los laboratorios de research para el diagnóstico. La respuesta de los anticuerpos persiste de por vida y por lo tanto, puede ser usada para establecer la prevalencia de la infección y evaluar los factores de riesgo para la transmisión. Varios formatos de test serológicos diagnósticos existen, pero solo unos pocos están disponibles. Un test muy usado es el ELISA.
Manifestaciones clínicas
Las implicaciones clínicas de este nuevo virus en los niños se desconocen. La mayoría pueden ser asintomáticas y muchos infectados no desarrollan enfermedades asociadas al virus. Sin embargo, pacientes VIHpositivos no tratados, que adquieren la infección por el SK después de la seroconversion, tienen una alta posibilidad de desarrollar SK. En los adultos, la secuencia del ADN VH-8 ha sido detectada en todas las formas del sarcoma de Kaposi en todas partes del mundo, en los linfomas de efusión primaria de la cavidad abdominal y pleural, en los síndromes linfoproliferativos y en la enfermedad multicéntrica de Castleman.
El SK es la neoplasia más común asociada al SIDA y se manifiesta por una forma multifocal; la localización en la piel es típica, con la aparición gradual de máculas de color rojo-purpúricas, parches o nódulos también purpúricos en las extremidades. Las localizaciones en la parte superior del cuerpo, invasión de las mucosas (orofaringe) y toma visceral (gastrointestinal y pulmón) son prominentes en las formas severas. La enfermedad multicéntrica de Castleman es mucho más rara, es una enfermedad linfoproliferativa atípica de la piel en pacientes con SIDA con SK concomitante. El linfoma de efusión primario es una forma de linfoma no-Hodgkin's en pacientes con SIDA que se caracteriza por una efusión maligna en una o varias cavidades del organismo, generalmente en ausencia de una masa tumoral primaria.
Bibliografía
- Jesús Perea C; Eric Martínez T. Pediatría, Tomo IV, Parte XVII. Cap. 113. Virus. Pag. 1539-1550.