Nitritos
| ||||||||||
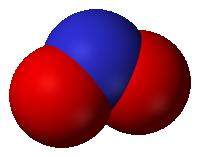
El nitrito es un ion de fórmula NO2−1. El anión es angular, siendo isoelectrónico con O3. Los nitritos son sales o ésteres del ácido nitroso (HNO2). Son sales de un ácido débil en contacto con ácidos fuertes como el ácido sulfúrico se libera el ácido nitroso inestable que en disolución ácida está en equilibrio con el ion de nitrosonio (NO+). Este interviene en diversas reacciones de sustitución electrofílica y en reacciones de síntesis de colorantes diazoicos.
Sumario
Estado Natural
En la naturaleza los nitritos se forman por oxidación biológica de las aminas y del amoníaco, o por reducción del nitrato en condiciones anaeróbicas.
En la industria se pueden obtener al disolver N2O3 en disoluciones básicas.
Tratándose de sales de un ácido débil en contacto con ácidos fuertes como el ácido sulfúrico se libera el ácido nitroso inestable que en disolución ácida está en equilibrio con el ion de nitrosonio (NO+). Este interviene en diversas reacciones de sustitución electrofílica y en reacciones de síntesis de colorantes diazoicos.
Propiedades físicas
- Nombre químico: Nitrito
- Nombre regulatorio: Nitrito
- Fórmula molecular: NO2-1
- Peso molecular: 46 g/mol
Determinación
El nitrito presente en el agua se determina por diazotación con sulfanilamida y copulación con clorhidrato de N-(1-naftil)-etilendiamina, para formar un colorante azoico de gran intensidad que se mide espectrofotométricamente a una longitud de onda de 540nm. Esta reacción, propuesta por Griess tiene su lugar en la historia de la Química por el hecho de ser la primera reacción de identificación en la que se empleó un reactivo orgánico, pues hasta ese momento solo se empleaban reactivos inorgánicos. También se analiza añadiéndole reactivo de Zambelli y midiéndolo espectrofotométricamente a 450nm.
Efectos sobre la salud
El nitrito es tóxico (2 g pueden causar la muerte una persona), al ser capaz de unirse a la hemoglobina de la sangre, de una forma semejante a como lo hace a la mioglobina dela carne, formándose metahemoglobina, un compuesto que ya no es capaz de transportar el oxígeno. Esta intoxicación puede ser mortal, y de hecho se conocen varios casos fatales por ingestión de embutidos con cantidades muy altas de nitritos, producidas localmente por un mal mezclado del aditivo con los otros ingredientes durante su fabricación. Para evitar esto, se puede utilizar el nitrito ya mezclado previamente con sal. En muchos paises, esto debe hacerse obligatoriamente y las normativas de la CE incluyen esta obligatoriedad. Los niños son mucho más susceptibles que los adultos a esta intoxicación, por su menor cantidad de hemoglobina, y en el caso de los muy jóvenes, por la pervivencia en su sangre durante un cierto tiempo despues del nacimiento de la forma fetal de la hemoglobina, aún más sensible al efecto de los nitritos.
El síntoma más obvio de la metahemoglobinemia es la aparición de un tono azulado en la piel, particularmente alrededor de los ojos y boca. Si se descubre con rapidez, esta enfermedad puede ser tratada exitosamente con una inyección de azul de metileno, que transforma la metahemoglobina de nuevo a hemoglobina. La enfermedad es extremadamente grave si no se trata: la muerte tiene lugar cuando el 70 por ciento de la hemoglobina del cuerpo ha sido transformada a metahemoglobina. Se ha demostrado que existe una relación entre las muertes de bebés por metahemoglobinemia y altos niveles de nitrato en agua.
Como eliminar los nitritos de su agua
Una solución fácil para eliminar los nitritos de su agua es oxidándolos a nitratos (como hemos dicho anteriormente, los nitratos son mucho menos tóxicos que los nitritos). Esto puede conseguirse mediante la inyección de ozono en el agua. El ozono es un producto químico muy oxidante que oxidará todos los nitritos a nitratos, eliminando de esta forma la toxicidad causada por los nitritos.
Aplicaciones
Los nitritos forman parte de muchas formulaciones de sales para Acecinar ó salar carnes (E249 = nitrito de potasio; E250 = nitrito desodio). Se debe a su capacidad se mantener un color rojizo deseado en la materia prima ya que reaccionan con la mioglobina de la carne. Sin embargo, la concentración debe ser baja ya que hay sospechas que favorecen el desarrollo de cáncer. Además por su interacción con la hemoglobina resultan tóxicos. Los nitritos son productos de partida en la síntesis de diversos compuestos químicos, sobre todo compuestos diazo. Su aplicación médica es como antídoto en caso de envenenamientos por cianuro de potasio, causando vasodilatación y es además antiespásmodico.
Fuente
- Química Inorgánica Adolfo Ponjuan Tomo I
- Química General Rafael león
- http://www.fq.uh.cu/dpto/qi/pag/tabla%20periodica/los%20elementos%20quimicos.htm
- Ignacio Puig Química Elemental. Iacobucci Celso