Ozonólisis
| ||||||
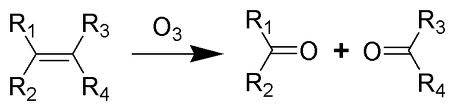
Ozonólisis. Es el nombre que recibe la reacción del ozono con compuestos orgánicos disueltos en un solvente y a través de la cual se forman los ozónidos, por ejemplo la reacción de un alqueno ó alquino con una molécula de ozono. Existe un gran número de reacciones de compuestos orgánicos con el ozono, como la producción de ozónidos, la reacción del ozono para formar aldehídos, dialdehídos, ácidoscarboxílicos, etc.
Sumario
Historia
El proceso de ozonólisis se utilizaba a gran escala para localizar la posición de los dobles enlaces de los compuestos etilénicos en las moléculas orgánicas. El descubrimiento de la reacción de ozonólisis se atribuye a Harries en 1903. Actualmente, las técnicas espectroscópicas permiten análisis más potentes con cantidades de producto más pequeñas y sin destrucción. Esta reacción sirve para transformar los alquenos en cetona / aldehído/ ácido carboxílico en síntesis orgánica. La ozonólisis es un paso en la oxidación altamente efectivo en la tecnología del procesamiento orgánico.
Reacciones de Ozonólisis
La ozonólisis es la adición de la molécula de ozono completa (O3) al compuesto, es decir, los tres átomos de oxígeno; no es una sustitución de un elemento o una molécula en el compuesto, como es el caso de otras reacciones de oxidación.
El proceso es exotérmico y por tanto implica que, para mantener unas condiciones estables, es requisito imprescindible tener un eficiente sistema de refrigeración. Los ozónidos así formados son estables también sólo a una temperatura baja y requieren que tanto el reactor como el equipo de proceso posterior se mantengan a una temperatura por debajo del nivel de desintegración de los ozónidos.
En estas reacciones se implica el uso del ozono en condiciones especiales, como rápidas reacciones cinéticas, materiales altamente inflamables y potencialmente explosivos y con un gas tóxico. Basados en la experiencia en el diseño y utilización de sistemas de ozonólisis (no sólo desde el punto de vista científico) los parámetros más significativos a tener en cuenta a la hora de aplicar el proceso están siendo debatidos.
Éstos parecen ser la elección del solvente, la temperatura del proceso, el diseño del reactor, el manejo de aerosoles, los efectos del ozono residual y el manejo de los gases de salida. Siempre que se aplique una correcta aproximación de la ingeniería química la ozonólisis es un económico oxidante alternativo en numerosos procesos químicos.
Siempre que se aplique una correcta ingeniería química, la ozonólisis no debe ser considerada como un proceso exótico. Puede hacerse de forma segura y puede aplicarse como una económica alternativa oxidante en numerosos procesos químicos.
El ozono es el único oxidante que puede emplearse en un sistema homogéneo que no implica añadir agua. Todos los demás oxidantes forman, además del producto deseado, subproductos que tienen que ser separados del producto, inmediatamente antes o después de los siguientes pasos del tratamiento. Por ejemplo, el peróxido de hidrógeno sólo puede utilizarse con agua que puede no ser beneficiosa para el proceso global si, en algún paso posterior del proceso, tiene que ser eliminada.
Ozonólisis de alquenos
La ozonólisis de alquenos consiste en una primera cicloadición 1,3-dipolar que genera el molozónido. La retro-1,3-dipolar rompe el molozónido y una nueva 1,3-dipolar genera un ozónido que se rompe para dar carbonilos y un átomo de oxígeno. Los alquenos reaccionan con ozono para formar aldehídos, cetonas o mezclas de ambos después de una etapa de reducción.
Mecanismo de la Ozonólisis
Etapa 1. Formación del molozónido mediante 1,3-dipolar.
El resultado global de la ozonólisis es la ruptura del doble enlace carbono-carbono de la molécula, el oxígeno se une a cada uno de los dos átomos que forman el doble enlace original formando aldehídos o cetonas.
La ozonólisis tiene lugar cuando cada carbono del alqueno se une a un oxígeno del ozono, el tercer oxígeno reacciona con el reductor. Una molécula de ozono se liga a los carbonos de un doble enlace carbono-carbono para dar lugar a un monoozónido u ozónido primario. Este ozónido, muy inestable, se escinde en dos moléculas que reaccionan entre sí para dar un ozónido secundario.
El ozónido, de carácter explosivo, se trata en general alrededor de -80 °C (193 K), y se separa en dos cetonas o aldehídos, según los sustituyentes iniciales de la olefina , y un átomo de oxígeno (que podrá reaccionar con los otros productos de la reacción, si no es capturado por ejemplo con dimetil sulfuro que dará dimetil sulfóxido (DMSO). Las reacciones son de reducción, con catalizadores de tipo hidrógeno H2 o platino Pt (metal), o de oxidación con peróxido de hidrógeno o agua oxigenada, H2O2.
La ozonólisis es un método importante para preparar aldehídos y cetonas, pero también se puede utilizar como método analítico para determinar alquenos. Conocidos los productos de la ozonólisis se puede determinar la estructura del alqueno.
Etapa 2. Ruptura del molozonido mediante retro-1,3-dipolar
La reacción 1,3-dipolar entre el ozono (dipolo) y un alqueno (dipolarófilo). Se establece para formar el molozónido que rompe mediante la retro-1.3-dipolar generando nuevos dipolo y dipolarófilo, que mediante una nueva 1,3-dipolar forman el ozónido. El ozónido rompe en la etapa de reducción dejando libres los carbonilos
Etapa 3. Formación del ozónido mediante 1,3-dipolar y reducción
Determina la estructura del alqueno que produce ciclohexanona y metanal en relación equimolar al romper con ozono
Ozonólisis de Alquinos
Los alquinos reaccionan con ozono para formar ácidos carboxílicos. En esta reacción se produce la ruptura del triple enlace, transformándose cada carbono del alquino en el grupo carboxílico.
Precauciones
El ozono es un compuesto bastante peligroso. Por una parte es tóxico, y por otras es explosivo. Por tanto hay que utilizar una campana de extracción bien ventilada y captar los efluentes a la fuente para su eliminación. Por otra parte, teniendo en cuenta su carácter explosivo, hay que evitar una alta concentración de ozono y por tanto evitar enfriar demasiado el medio de reacción ya que aumenta la solubilidad del ozono en el disolvente y si el ozono se licúa se produce explosión.
Fuentes
- Bonner WA, Castro AJ. Química Orgánica Básica. 2 ed. La Habana; Editorial Pueblo y Revolución. 1979
- Artículo. Ozonólisis. Disponible en: "www.actualiatecnologia.com". Consultado: 6 de agosto de 2012
- Artículo. Ozonólisis-alquenos. Disponible en: "www.quimicaorganica.org". Consultado: 6 de agosto de 2012.
- Artículo. Alquinos-ozonólisis. Disponible en: "www.quimicaorganica.org". Consultado: 6 de agosto de 2012