Diferencia entre revisiones de «Tabla periódica de 18 columnas»
m (Texto reemplazado: «<div align="justify">» por «») |
|||
| (No se muestran 14 ediciones intermedias de 6 usuarios) | |||
| Línea 1: | Línea 1: | ||
{{Definición | {{Definición | ||
| − | |nombre= | + | |nombre=Tabla periódica de 18 columnas |
| − | |imagen= | + | |imagen=TP_18_colum.JPG |
| − | |tamaño= | + | |tamaño= |
| − | |concepto= | + | |concepto=Es una forma larga de [[Tabla Periódica de Elementos|Tabla Periódica de Elementos Químicos]], que refleja la estructura de los elemento y su orden en siete hileras horizontales, llamadas períodos, y en 18 columnas verticales, llamadas grupos. |
| − | }} | + | }} |
| − | + | '''Tabla Periódica de 18 columnas'''. Esta forma de [[Tabla Periódica de Elementos|Tabla Periódica de Elementos Químicos]] es adoptada por la norma cubana y se utiliza actualmente para la enseñanza de la Química, este sistema periódico intenta destacar tanto las relaciones químicas como las electrónicas. Las líneas horizontales se denominan períodos, cada periodo corresponde a la formación de una nueva capa de electrones. Los elementos alineados tienen estructuras electrónicas estrictamente análogas. El principio y el final de un periodo largo representan la adición de electrones en una capa de valencia; en la parte central aumenta el número de electrones de una capa subyacente. | |
| − | |||
| − | |||
== Características de la tabla periódica == | == Características de la tabla periódica == | ||
| − | + | La tabla periódica ayuda a comprender el comportamiento, las propiedades y la reactividad de los elementos. Las propiedades de los elementos tienden a reproducirse de manera regular (periódica) al ordenar a los elementos según su número atómico. | |
| − | |||
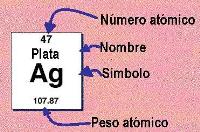
| − | En este figuran el correspondiente nombre, símbolo, número atómico, la masa atómica(Peso atómico), y otros datos. [[Image:Inform de elemento qco.JPG| | + | A cada elemento químico le corresponde un casillero. En este figuran el correspondiente nombre, símbolo, número atómico, la masa atómica(Peso atómico), y otros datos. [[Image:Inform de elemento qco.JPG|thumb|Información de un elemento químico]]. A partir de su ubicación en la tabla periódica se puede deducir la estructura atómica del elemento. |
| − | |||
| − | |||
Se encuentran ubicados: <br> | Se encuentran ubicados: <br> | ||
| − | ==== | + | ==== Elementos metálicos ==== |
| − | + | [[Image:Elementos metalicos.jpg|thumb|right|312x146px|Elementos metálicos]] | |
Los metales se encuentran a la izquierda de la tabla, de ellos:<br> | Los metales se encuentran a la izquierda de la tabla, de ellos:<br> | ||
| Línea 27: | Línea 22: | ||
*2 elementos son líquidos | *2 elementos son líquidos | ||
| − | El primer elemento de cada periodo (Li(Litio), Na(Sodio), K(Potasio), etc.) presenta carácter metálico muy evidente, el cual disminuye a medida que se avanza horizontalmente hacia la derecha, mientras se van manifestando las características propias de los no metales. Los elementos del grupo 17 son francamente no metales. | + | El primer elemento de cada periodo (Li([[Litio]]), Na([[Sodio]]), K([[Potasio]]), etc.) presenta carácter metálico muy evidente, el cual disminuye a medida que se avanza horizontalmente hacia la derecha, mientras se van manifestando las características propias de los no metales. Los elementos del grupo 17 son francamente no metales. |
| − | Los elementos situados después del uranio, reciben el nombre de transuránidos. Estos elementos no existen en la | + | Los elementos situados después del [[uranio]], reciben el nombre de transuránidos. Estos elementos no existen en la naturaleza y han sido obtenidos artificialmente por reacciones nucleares. |
| − | + | '''Algunas propiedades de los metales''' | |
| − | En general, la mayoría de los metales tienen las propiedades siguientes: | + | En general, la mayoría de los metales tienen las propiedades siguientes: |
#Son dúctiles y maleables. | #Son dúctiles y maleables. | ||
| − | # | + | #Presentan brillo (lustre) |
| − | # | + | #Son buenos conductores del calor |
| − | # | + | #Son buenos conductores de la electricidad |
| − | # | + | #Todos excepto el Hg son sólidos a temperatura ambiente |
| − | # | + | #Al hacer reaccionar su sustancia simple con la sustancia simple no metálica ceden electrones |
| − | ==== | + | ==== Elementos no metálicos ==== |
| − | + | Se conocen 17 elementos químicos que son no metales de ellos: | |
| + | *11 son gases a presión y temperatura normales | ||
| + | *6 son gases nobles monoatómicos | ||
| − | '''Algunas propiedades de los no metales''' | + | '''Algunas propiedades de los no metales''' |
| − | En general, pueden presentar todos los estados de agregación a temperatura y presión | + | En general, pueden presentar todos los estados de agregación a temperatura y presión estándar ambiente (TPEA) |
| − | #El dicloro (Cl2) es un gas, el dibromo (Br2) es líquido, el diyodo(I2) es sólido | + | #El [[cloro|dicloro]] (Cl2) es un gas, el [[|bromo|dibromo]] (Br2) es líquido, el [[yodo|diyodo]](I2) es sólido |
| − | #Generalmente son malos conductores del calor. | + | #Generalmente son malos conductores del calor. |
| − | #Generalmente son malos conductores de la electricidad. | + | #Generalmente son malos conductores de la electricidad. |
| − | #Muchos de ellos existen como moléculas diatómicas | + | #Muchos de ellos existen como moléculas diatómicas |
#Las sustancias simples que forman al reaccionar con las sustancias simples metálicas captan electrones | #Las sustancias simples que forman al reaccionar con las sustancias simples metálicas captan electrones | ||
#Las sustancias simples que forman al reaccionar con sustancias simples no-metálicos comparten electrones. | #Las sustancias simples que forman al reaccionar con sustancias simples no-metálicos comparten electrones. | ||
| − | '''Observaciones generales''' | + | '''Observaciones generales''' |
| − | + | *Al [[hidrógeno]] no se lo ha encontrado una ubicación satisfactoria, pues por su estructura electrónica le corresponde el grupo 1, pero sus propiedades se asemejan más al grupo 17. | |
| + | *Una línea quebrada que pasa entre el [[boro]] (B) y el [[aluminio]](Al) y desciende hasta el [[polonio]](Po) y el [[astato]](At) señala la separación entre metales y no metales. Esta separación no debe ser considerada como un limite absoluto entre metales y no metales | ||
| − | + | ====Metaloides ==== | |
| + | Elementos químicos que presentan características tanto de los metales como de los no metales,se encuentran ubicado cerca del límite de la línea quebrada, (Al([[Aluminio]]), Si([[Silicio]]), Ge([[Germanio]]), As([[Arsénico]]), etc.) | ||
| − | + | '''Algunas propiedades de los metaloides''' | |
| − | + | En general, estos elementos tienen propiedades muy variadas y variables. Es decir dependiendo con quien anden, cambiaran de carácter. | |
| − | + | *Actúan como sustancias simples no metálicas cuando reaccionan con sustancias metálicas | |
| + | *Actúan como sustancias metálicas cuando reaccionan con las sustancias simples no metálicas | ||
| + | *Algunos de ellos presentan la propiedad eléctrica de ser semiconductores. | ||
| − | === | + | === Períodos === |
| − | + | Las filas horizontales de la tabla periódica son llamadas períodos. Contrario a como ocurre en el caso de los grupos de la tabla periódica, los elementos que componen una misma fila tienen propiedades diferentes pero masas similares: todos los elementos de un período tienen el mismo número de orbitales. Siguiendo esa norma, cada elemento se coloca según su configuración electrónica. | |
| − | |||
| − | Los elementos en el | + | El primer período solo tiene dos miembros: hidrógeno(H) y [[helio]](He); ambos tienen sólo el orbital 1s -H 1s1, He 1s2- , y los dos periodos siguientes(2 y 3), cada uno con ocho elementos, se llaman periodos cortos. Los periodos restantes, llamados periodos largos, contienen 18 elementos en el caso de los periodos 4 y 5, o 32 elementos en el del periodo 6. El periodo largo 7 incluye el grupo de los actínidos, que ha sido completado sintetizando núcleos radiactivos más allá del elemento 92, el uranio. |
| − | + | El periodo que ocupa un elemento coincide con su última capa electrónica. Es decir, un elemento con cinco capas electrónicas, estará en el quinto período. | |
| + | La tabla periódica consta de 7 períodos: | ||
| + | |||
| + | *Período 1: tiene sólo dos elementos químicos. | ||
| + | *Período 2 y Período 3: Tienen ocho elementos químicos. | ||
| + | *Período 4 y 5:Tienen dieciocho elementos químicos. | ||
| + | *Período 6: Tiene treinta y dos elementos químicos.: | ||
| + | *Período 7: Incompleto | ||
| − | + | Estos dos últimos periodos tienen catorce elementos separados, para no alargar demasiado la tabla y facilitar su trabajo con ella. | |
| − | + | El número del período indica la cantidad de niveles energéticos (órbitas) que tienen los átomos de los elementos que se ubican en dicho período. Así, el H y el He que están en el período 1 tienen una sola órbita; el Li al estar en el período 2 cuenta con dos órbitas, etcétera.<br> | |
| − | + | ||
| − | + | === Grupos === | |
| − | + | A las columnas verticales de la tabla periódica se les conoce como grupos, Está constituida por 18 columnas o familias, las cuales se ordenan en grupos;. 8 grupos A y 8 grupos B. | |
| − | + | ||
| − | + | Todos los elementos que pertenecen a un grupo tienen la misma valencia atómica, y por ello, tienen características o propiedades similares entre sí. Por ejemplo: los elementos en el grupo IA tienen valencia de I (un electrón en su último nivel de energía) y todos tienden a ceder ese electrón al enlazarse como iones positivos de +1. | |
| + | |||
| + | Los grupos '''se numeran de izquierda a derecha''', según la última recomendación de la IUPAC, asignándole a cada familia un número arábigo del 1 al 18 (y entre paréntesis según la antigua propuesta de la IUPAC, asignándole a cada grupo un número romano con una letra A o B),los grupos de la tabla periódica son: | ||
| − | Grupo 1 (I A): los metales alcalinos | + | *Grupo 1 (I A): los metales alcalinos |
| + | *Grupo 2 (II A): los metales alcalinotérreos | ||
| + | *Grupo 3 (III B): Familia del [[Escandio]] | ||
| + | *Grupo 4 (IV B): Familia del [[Titanio]] [[Image:Grupo tp.JPG|thumb|right|Grupo]] | ||
| + | *Grupo 5 (V B): Familia del [[Vanadio]] | ||
| + | *Grupo 6 (VI B): Familia del [[Cromo]] | ||
| + | *Grupo 7 (VII B): Familia del [[Manganeso]] | ||
| + | *Grupo 8 (VIII B): Familia del [[Hierro]] | ||
| + | *Grupo 9 (VIII B): Familia del [[Cobalto]] | ||
| + | *Grupo 10 (VIII B): Familia del [[Níquel]] | ||
| + | *Grupo 11 (I B): Familia del [[Cobre]] | ||
| + | *Grupo 12 (II B): Familia del [[Zinc]] | ||
| + | *Grupo 13 (III A): los térreos | ||
| + | *Grupo 14 (IV A): los carbonoideos | ||
| + | *Grupo 15 (V A): los nitrogenoideos | ||
| + | *Grupo 16 (VI A): los calcógenos o anfígenos | ||
| + | *Grupo 17 (VII A): los halógenos | ||
| + | *Grupo 18 (VIII A): los gases nobles | ||
| − | + | En un grupo, las propiedades químicas son muy similares, porque todos los elementos del grupo tienen el mismo número de electrones en su última o últimas capas. | |
| − | |||
| − | |||
| − | + | Los elementos en el último grupo de la derecha son los gases nobles, los cuales tienen lleno su último nivel de energía (regla del octeto) y, por ello, son todos extremadamente no reactivos. | |
| − | |||
| − | |||
| − | + | ==== Algunas propiedades de los gases nobles ==== | |
| − | + | [[Image:Gases Nobles.JPG|thumb|Gases Nobles]] | |
| − | + | #En general, estos elementos no reaccionan con casi nadie. | |
| + | #Todos son gases monoatómicos en condiciones normales | ||
| + | #Son muy poco reactivos, de hecho He, Ne y Ar no reaccionan con nada | ||
| + | #El Kr y el Xe reaccionan con O y F y forman algunos compuestos. | ||
| + | #El Rn es radiactivo. | ||
| − | + | == Ventajas e inconvenientes del sistema periódico de 18 columnas. == | |
| + | Las ventajas de esta ordenación en comparación con la de 8 columnas son: | ||
| + | #. Los períodos largos no se doblan ni alteran para forzarlos a una distribución en ocho columnas. | ||
| + | #. Desaparece la confusión creada por los subgrupos. | ||
| + | #. Existe una separación entre metales y no metales. Los no metales quedan agrupados en la parte superior derecha por encima de la diagonal. | ||
| + | #. Los grupos encabezados por el Hierro (Fe), el Cobalto (Co) y el Níquel (Ni) tienen ya un lugar determinado. | ||
| + | Al examinar la tabla de periódica de los elementos químicos de 18 columnas puede verse que, si bien se han solucionado cuatro de los inconvenientes de la tabla de ocho columnas, el Hidrógeno (H) y los lantánidos y actínidos, todavía no tienen un lugar lógico en esta tabla. Además, al dividir los períodos segundo y tercero, cada uno de los cuales tiene ocho elementos, se ha introducido un inconveniente nuevo. Los períodos se partieron para dar cabida a los elementos de transición. | ||
| − | + | == Sistema periódico como instrumento de trabajo== | |
| + | En general, la tabla periódica no es tan exacta como para que, conociendo las propiedades de un elemento de un grupo determinado, podamos predecir las propiedades exactas de los restantes elementos de dicho grupo. | ||
| − | + | El sistema periódico orienta e indica una tendencia, pero no puede proporcionar detalles exactos. Sin embargo, su valor como guía para el estudio sistemático de las propiedades de los elementos y sus compuestos, compensa con mucho la desventaja que pueda suponer la falta de información detallada. Con la tabla periódica se puede predecir cómo combinar los distintos tipos de elementos, calcular masas y por ende cantidad de sustancia de las sustancias que pueden conformar la combinación de los elementos, así como conocer las propiedades periódicas de los átomos involucrados. | |
| − | + | La tabla periódica es un instrumento muy útil para organizar la química de los elementos y sus compuestos.Esta tabla aparece bastante modificada, ya que se ordenan los elementos por orden creciente de número atómico. Dicha tabla, a la que llamamos Tabla Periódica o Sistema Periódico, es una expresión de las relaciones que existen entre los elementos químicos. Por eso, favorece su estudio y permite deducir muchas de sus propiedades con sólo saber su situación en ella. | |
| + | == Fuentes == | ||
| + | * [http://html.rincondelvago.com/la-tabla-periodica_1.html La Tabla periódica] | ||
| + | * Lic. Irene Vera, Maria: Química General, Unidad III: Distribución de electrones en los átomos. Disponible en: [http://exa.unne.edu.ar/quimica/quimgeneral/UnidadIIINumerosCuanticos.pdf http://exa.unne.edu.ar] | ||
| + | *Lara Piñeiro. A.R. E. Calero Martín y J. Labadié Suárez: Química General. Ed. Pueblo y Educación. Ciudad de La Habana, [[Cuba]]. [[1987]]. | ||
| + | *León Ramírez, R.: Química General. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. [[1985]] | ||
</div> | </div> | ||
[[Category:Química_inorgánica]] | [[Category:Química_inorgánica]] | ||
| − | |||
| − | |||
última versión al 21:38 3 sep 2019
| ||||||
Tabla Periódica de 18 columnas. Esta forma de Tabla Periódica de Elementos Químicos es adoptada por la norma cubana y se utiliza actualmente para la enseñanza de la Química, este sistema periódico intenta destacar tanto las relaciones químicas como las electrónicas. Las líneas horizontales se denominan períodos, cada periodo corresponde a la formación de una nueva capa de electrones. Los elementos alineados tienen estructuras electrónicas estrictamente análogas. El principio y el final de un periodo largo representan la adición de electrones en una capa de valencia; en la parte central aumenta el número de electrones de una capa subyacente.
Sumario
Características de la tabla periódica
La tabla periódica ayuda a comprender el comportamiento, las propiedades y la reactividad de los elementos. Las propiedades de los elementos tienden a reproducirse de manera regular (periódica) al ordenar a los elementos según su número atómico.
A cada elemento químico le corresponde un casillero. En este figuran el correspondiente nombre, símbolo, número atómico, la masa atómica(Peso atómico), y otros datos.
. A partir de su ubicación en la tabla periódica se puede deducir la estructura atómica del elemento.
Se encuentran ubicados:
Elementos metálicos
Los metales se encuentran a la izquierda de la tabla, de ellos:
- 87 elementos son metales
- 26 elementos radioactivos
- 16 elementos han sido fabricados por el hombre (radioactivos todos)
- 2 elementos son líquidos
El primer elemento de cada periodo (Li(Litio), Na(Sodio), K(Potasio), etc.) presenta carácter metálico muy evidente, el cual disminuye a medida que se avanza horizontalmente hacia la derecha, mientras se van manifestando las características propias de los no metales. Los elementos del grupo 17 son francamente no metales.
Los elementos situados después del uranio, reciben el nombre de transuránidos. Estos elementos no existen en la naturaleza y han sido obtenidos artificialmente por reacciones nucleares.
Algunas propiedades de los metales
En general, la mayoría de los metales tienen las propiedades siguientes:
- Son dúctiles y maleables.
- Presentan brillo (lustre)
- Son buenos conductores del calor
- Son buenos conductores de la electricidad
- Todos excepto el Hg son sólidos a temperatura ambiente
- Al hacer reaccionar su sustancia simple con la sustancia simple no metálica ceden electrones
Elementos no metálicos
Se conocen 17 elementos químicos que son no metales de ellos:
- 11 son gases a presión y temperatura normales
- 6 son gases nobles monoatómicos
Algunas propiedades de los no metales
En general, pueden presentar todos los estados de agregación a temperatura y presión estándar ambiente (TPEA)
- El dicloro (Cl2) es un gas, el [[|bromo|dibromo]] (Br2) es líquido, el diyodo(I2) es sólido
- Generalmente son malos conductores del calor.
- Generalmente son malos conductores de la electricidad.
- Muchos de ellos existen como moléculas diatómicas
- Las sustancias simples que forman al reaccionar con las sustancias simples metálicas captan electrones
- Las sustancias simples que forman al reaccionar con sustancias simples no-metálicos comparten electrones.
Observaciones generales
- Al hidrógeno no se lo ha encontrado una ubicación satisfactoria, pues por su estructura electrónica le corresponde el grupo 1, pero sus propiedades se asemejan más al grupo 17.
- Una línea quebrada que pasa entre el boro (B) y el aluminio(Al) y desciende hasta el polonio(Po) y el astato(At) señala la separación entre metales y no metales. Esta separación no debe ser considerada como un limite absoluto entre metales y no metales
Metaloides
Elementos químicos que presentan características tanto de los metales como de los no metales,se encuentran ubicado cerca del límite de la línea quebrada, (Al(Aluminio), Si(Silicio), Ge(Germanio), As(Arsénico), etc.)
Algunas propiedades de los metaloides En general, estos elementos tienen propiedades muy variadas y variables. Es decir dependiendo con quien anden, cambiaran de carácter.
- Actúan como sustancias simples no metálicas cuando reaccionan con sustancias metálicas
- Actúan como sustancias metálicas cuando reaccionan con las sustancias simples no metálicas
- Algunos de ellos presentan la propiedad eléctrica de ser semiconductores.
Períodos
Las filas horizontales de la tabla periódica son llamadas períodos. Contrario a como ocurre en el caso de los grupos de la tabla periódica, los elementos que componen una misma fila tienen propiedades diferentes pero masas similares: todos los elementos de un período tienen el mismo número de orbitales. Siguiendo esa norma, cada elemento se coloca según su configuración electrónica.
El primer período solo tiene dos miembros: hidrógeno(H) y helio(He); ambos tienen sólo el orbital 1s -H 1s1, He 1s2- , y los dos periodos siguientes(2 y 3), cada uno con ocho elementos, se llaman periodos cortos. Los periodos restantes, llamados periodos largos, contienen 18 elementos en el caso de los periodos 4 y 5, o 32 elementos en el del periodo 6. El periodo largo 7 incluye el grupo de los actínidos, que ha sido completado sintetizando núcleos radiactivos más allá del elemento 92, el uranio.
El periodo que ocupa un elemento coincide con su última capa electrónica. Es decir, un elemento con cinco capas electrónicas, estará en el quinto período. La tabla periódica consta de 7 períodos:
- Período 1: tiene sólo dos elementos químicos.
- Período 2 y Período 3: Tienen ocho elementos químicos.
- Período 4 y 5:Tienen dieciocho elementos químicos.
- Período 6: Tiene treinta y dos elementos químicos.:
- Período 7: Incompleto
Estos dos últimos periodos tienen catorce elementos separados, para no alargar demasiado la tabla y facilitar su trabajo con ella.
El número del período indica la cantidad de niveles energéticos (órbitas) que tienen los átomos de los elementos que se ubican en dicho período. Así, el H y el He que están en el período 1 tienen una sola órbita; el Li al estar en el período 2 cuenta con dos órbitas, etcétera.
Grupos
A las columnas verticales de la tabla periódica se les conoce como grupos, Está constituida por 18 columnas o familias, las cuales se ordenan en grupos;. 8 grupos A y 8 grupos B.
Todos los elementos que pertenecen a un grupo tienen la misma valencia atómica, y por ello, tienen características o propiedades similares entre sí. Por ejemplo: los elementos en el grupo IA tienen valencia de I (un electrón en su último nivel de energía) y todos tienden a ceder ese electrón al enlazarse como iones positivos de +1.
Los grupos se numeran de izquierda a derecha, según la última recomendación de la IUPAC, asignándole a cada familia un número arábigo del 1 al 18 (y entre paréntesis según la antigua propuesta de la IUPAC, asignándole a cada grupo un número romano con una letra A o B),los grupos de la tabla periódica son:
- Grupo 1 (I A): los metales alcalinos
- Grupo 2 (II A): los metales alcalinotérreos
- Grupo 3 (III B): Familia del Escandio
- Grupo 4 (IV B): Familia del Titanio
- Grupo 5 (V B): Familia del Vanadio
- Grupo 6 (VI B): Familia del Cromo
- Grupo 7 (VII B): Familia del Manganeso
- Grupo 8 (VIII B): Familia del Hierro
- Grupo 9 (VIII B): Familia del Cobalto
- Grupo 10 (VIII B): Familia del Níquel
- Grupo 11 (I B): Familia del Cobre
- Grupo 12 (II B): Familia del Zinc
- Grupo 13 (III A): los térreos
- Grupo 14 (IV A): los carbonoideos
- Grupo 15 (V A): los nitrogenoideos
- Grupo 16 (VI A): los calcógenos o anfígenos
- Grupo 17 (VII A): los halógenos
- Grupo 18 (VIII A): los gases nobles
En un grupo, las propiedades químicas son muy similares, porque todos los elementos del grupo tienen el mismo número de electrones en su última o últimas capas.
Los elementos en el último grupo de la derecha son los gases nobles, los cuales tienen lleno su último nivel de energía (regla del octeto) y, por ello, son todos extremadamente no reactivos.
Algunas propiedades de los gases nobles
- En general, estos elementos no reaccionan con casi nadie.
- Todos son gases monoatómicos en condiciones normales
- Son muy poco reactivos, de hecho He, Ne y Ar no reaccionan con nada
- El Kr y el Xe reaccionan con O y F y forman algunos compuestos.
- El Rn es radiactivo.
Ventajas e inconvenientes del sistema periódico de 18 columnas.
Las ventajas de esta ordenación en comparación con la de 8 columnas son:
- . Los períodos largos no se doblan ni alteran para forzarlos a una distribución en ocho columnas.
- . Desaparece la confusión creada por los subgrupos.
- . Existe una separación entre metales y no metales. Los no metales quedan agrupados en la parte superior derecha por encima de la diagonal.
- . Los grupos encabezados por el Hierro (Fe), el Cobalto (Co) y el Níquel (Ni) tienen ya un lugar determinado.
Al examinar la tabla de periódica de los elementos químicos de 18 columnas puede verse que, si bien se han solucionado cuatro de los inconvenientes de la tabla de ocho columnas, el Hidrógeno (H) y los lantánidos y actínidos, todavía no tienen un lugar lógico en esta tabla. Además, al dividir los períodos segundo y tercero, cada uno de los cuales tiene ocho elementos, se ha introducido un inconveniente nuevo. Los períodos se partieron para dar cabida a los elementos de transición.
Sistema periódico como instrumento de trabajo
En general, la tabla periódica no es tan exacta como para que, conociendo las propiedades de un elemento de un grupo determinado, podamos predecir las propiedades exactas de los restantes elementos de dicho grupo.
El sistema periódico orienta e indica una tendencia, pero no puede proporcionar detalles exactos. Sin embargo, su valor como guía para el estudio sistemático de las propiedades de los elementos y sus compuestos, compensa con mucho la desventaja que pueda suponer la falta de información detallada. Con la tabla periódica se puede predecir cómo combinar los distintos tipos de elementos, calcular masas y por ende cantidad de sustancia de las sustancias que pueden conformar la combinación de los elementos, así como conocer las propiedades periódicas de los átomos involucrados.
La tabla periódica es un instrumento muy útil para organizar la química de los elementos y sus compuestos.Esta tabla aparece bastante modificada, ya que se ordenan los elementos por orden creciente de número atómico. Dicha tabla, a la que llamamos Tabla Periódica o Sistema Periódico, es una expresión de las relaciones que existen entre los elementos químicos. Por eso, favorece su estudio y permite deducir muchas de sus propiedades con sólo saber su situación en ella.
Fuentes
- La Tabla periódica
- Lic. Irene Vera, Maria: Química General, Unidad III: Distribución de electrones en los átomos. Disponible en: http://exa.unne.edu.ar
- Lara Piñeiro. A.R. E. Calero Martín y J. Labadié Suárez: Química General. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1987.
- León Ramírez, R.: Química General. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1985