Diastereomerismo
| ||||||
Diastereomerismo.Se produce cuando dos o más estereoisómeros de un compuesto tienen configuraciones diferentes en una o más, pero no todas, las equivalentes relacionadas. Los estereocentros no son imágenes especulares uno del otro. Cuando dos diastereoisómeros se diferencian entre sí en un solo estereocentro son epímeros. Cada estereocentro da lugar a dos configuraciones diferentes y por lo tanto aumenta el número de estereoisómeros en un factor de dos.
Características
Los diastereoisómeros difieren en sus propiedades físicas y químicas. Por ello pueden separarse mediante procedimientos de destilación, cristalización o cromatografía. Los diastereoisómeros se diferencian de los enantiómeros ya que estos últimos son los pares de estereoisómeros que difieren de todos los estereocentros y por lo tanto son reflejos uno del otro. Los enantiómeros de un compuesto con más de un estereocentro también son llamados diastereoisómeros de los otros estereoisómeros del compuesto que no es su imágen especular. Los diastereómeros tienen diferentes propiedades físicas y diferente reactividad, a diferencia de los [enantiómeros].
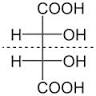
Dentro del grupo de los diastereómeros se encuentran los isómeros cis-trans (antes conocidos como isómeros geométricos), los confórmeros o isómeros conformacionales y, en las moléculas con varios centros quirales, los isómeros que pertenecen a distintas parejas de enantiómeros. Si una molécula tiene varios centros quirales obtendremos diastereómeros cambiando la configuración absoluta de uno de los centros quirales y manteniendo la del resto; veámoslo en el ácido tartárico:
Tautomería
Es un tipo especial de isomería en la que existe transposición de un átomo entre las dos estructuras, generalmente hidrógeno, existiendo además un fácil equilibrio entre ambas formas tautómeras. Un ejemplo de la misma es la tautomería ceto-enólica en la que existe equilibrio entre un compuesto con grupo OH unido a uno de los átomos de carbono de un doble enlace C=C, y un compuesto con el grupo carbonilo intermedio, C=O típico de las cetonas, con transposición de un átomo de hidrógeno.
Mezcla racémica
Una mezcla racémica es la mezcla equimolecular de los isómeros dextro y levo. Esta fórmula es ópticamente inactiva (no desvía el plano de la luz polarizada). La mezcla de ácido D-láctico y L-láctico forma una mezcla racémica, ópticamente inactiva.. Si un compuesto posee dos carbonos asimétricos, puede tener uno dextrógiro y otro levógiro, pero si tiene un plano de simetría, en conjunto se comporta como ópticamente inactivo y recibe el nombre de forma meso. Es el caso del ácido tartárico o 2,3-dihidroxibutanodioico, uno de cuyos isómeros es una forma meso.
Poder rotatorio específico Es la desviación que sufre el plano de polarización al atravesar la luz polarizada una disolución con una concentración de 1 gramo de sustancia por cm³ en un recipiente de 1 dm de altura. Es el mismo para ambos enantiómeros, aunque de signo contrario. Se mide con el polarímetro.
Enlaces externos
Fuentes
1.IUPAC Gold Book. Compendium of Chemical Terminology. 2a. ed. ([1997]). Versión en línea: ([2006]-) "enantiomer"
2.IUPAC Gold Book. Compendium of Chemical Terminology, 2ª ed. (1997). Versión en línea: (2006-) "enantiomerically pure (enantiopure)"
3.Medicamentos: Un viaje a lo largo de la evolución histórica del descubrimiento de fármacos Volumen 2. Enrique Raviña Rubira, Editorial de la Universidad de Santiago de Compostela, [2008]. ISBN: 8498870089.
4.Química farmacéutica. En: Remington Farmacia. The Science and Practice of Pharmacy. Volumen 1. Alfonso R. Gennaro, Ed. Médica Panamericana, 2003. ISBN: 9500618664.
5.Tratado de Química Orgánica: Tomo 1 (1ª parte). Química Orgánica sistemática. F. Klages. Editorial Reverté, [1968]. ISBN: 8429173145.
6.Nomenclatura D-L. Curso de biomoléculas. Juan Manuel González Mañas. Universidad del País Vasco.