Esterol
| ||||||
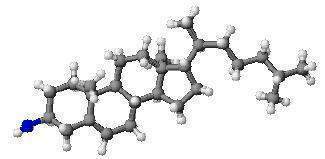
Esteroles. Se da este nombre a un grupo de alcoholes monohidroxílicos policíclicos que se encuentran ampliamente difundidos en el reino animal y vegetal. Las moléculas de estos alcoholes contienen cuatro anillos de carbono, entre ellos tres son hexagonales pero sin carácter aromático.
Sumario
- 1 Historia
- 2 Distribución y estado natural
- 3 Propiedades físicas
- 4 Biogénesis
- 5 Hechos estructurales
- 6 Métodos de análisis
- 7 Nomenclatura iupac de 3-hidroxiesteroides
- 8 Actividad fisiológica, síntesis y degradación microbiológica de esteroles
- 9 Referencias
- 10 Fuentes
Historia
El esterol más antiguo conocido es el colesterol (del griego ¨cole¨ - bilis, ¨stereos¨ - sólido) C27H45OH. Se encuentra en forma de ésteres en casi todos los órganos humanos, pero en cantidades particularmente masivas en el cerebro y en los nervios. El colesterol fue aislado primeramente de los cálculos biliares humanos (constituidos casi completamente por colesterol). Es un sólido cristalino (p.f. 149º C); su estructura fue esclarecida en 1932, gracias, principalmente a los trabajos de Wieland y Windaus. Según fórmula:
Los esteroles son esteroides con 27 a 29 átomos de carbono. Su estructura química deriva del ciclopentanoperhidrofenantreno o esterano, una molécula de 17 carbonos formada por tres anillos hexagonales y uno pentagonal. En los esteroles, se añade una cadena lateral de 8 o más átomos de carbono en el carbono 17 y un grupo alcohol o hidroxilo (-OH) en el carbono 3. Estas sustancias se encuentran en abundancia en los organismos vivos, sobre todo en animales y en algunas algas rojas. Son solubles en los disolventes orgánicos, y poseen un elevado punto de fusión.
Distribución y estado natural
Los esteroles se encuentran ampliamente distribuidos en los reinos animal y vegetal; y se les encuentra en forma libre (También llamados agliconas esteroides), como ésteres o como glicósidos. Todos contienen un núcleo ciclopentanoperhidrofenantreno y presentan un grupo hidroxilo en el carbono 3. La mayoría de esteroles naturales poseen una cadena lateral de 8 a 10 átomos de carbono y un enlace doble en el C-5 (Figura 1).
En los animales superiores (Incluido el hombre) se encuentra principalmente el colesterol, el cual es un constituyente importante de membranas y precursor de sustancias fisiológicamente importantes (Hormonas, Ácidos biliares, Vitamina D, etc.).
En las plantas superiores se encuentran principalmente los denominados fitosteroles: b-Sitosterol, Campesterol y Estigmasterol. Un esterol menos común es el Fucosterol, el cual es el esteroide principal de muchas algas pardas y también se le ha detectado en el coco (Cocus nucifera L.).
En los hongos y levaduras se encuentra principalmente el Ergosterol. En cambio, los animales inferiores (Principalmente invertebrados marinos tales como esponjas, estrellas, corales, etc.) y ciertas plantas filogenéticamente poco evolucionadas (P.ej. algunas Orchidaceae) contienen mezclas complejas de esteroles con modificaciones estructurales variadas tales como núcleos sin el carbono 4 (A-nor-esteroles), sin el carbono 19 (19-Nor-esteroles), con varias insaturaciones; cadenas laterales con más de 10 carbonos, con anillos ciclopropano, con enlaces alénicos, etc. En la Figura 2 se presentan algunos ejemplos.
Con base en la diversidad estructural observada para los esteroles terrestres y marinos identificados hasta 1978, y trabajando sobre consideraciones biosintéticas, es interesante resaltar que a través de un programa de computador denominado REACT Varkony y col. predijeron la existencia de 1778 esteroles naturales1.
Propiedades físicas
La gran mayoría de esteroles conocidos son sólidos cristalinos incoloros, solubles en solventes orgánicos relativamente apolares (Cloroformo, Benceno, etc.), menos solubles en alcoholes de bajo peso molecular, y que funden sin descomponerse (En forma libre o esterificada). Presentan además actividad óptica debido a los carbonos asimétricos que poseen. Los esteroles se pueden recristalizar en metanol caliente o en la mezcla metanol-tetrahidrofurano 10:1, formando cristales en forma de agujas brillantes incoloras. Los que presentan dobles enlaces conjugados son de color amarillento y tienden a descomponerse por acción de la luz como por ejemplo los esteroles con insaturaciones en C-5 y C-7, los cuales son susceptibles a la reacción de oxidación fotoquímica:
Biogénesis
Los esteroles se derivan biogenéticamente de la AcetilCoA (Ruta del Acetato) vía mevalonato y escualeno. Los esteroles vegetales tienen como precursor inmediato al cicloartenol2, mientras que los animales tienen al lanosterol (Figura 3). De una forma análoga se originan los triterpenoides.
En la biogénesis de los esteroles también están implicados procesos tales como hidrogenaciones y deshidrogenaciones C-C, metilaciones (vía Sadenosilmetionina), hidroxilaciones, etc. Un hecho estructural notable es que la gran mayoría de esteroles naturales tienen sustituyentes alquílicos sobre los carbonos 4 y 24 fundamentalmente, y este hecho es justificado por la misma biogénesis.
El conocimiento de la biosíntesis de esteroides ha contribuido al desarrollo de la Quimotaxonomía vegetal, particularmente en el caso de las algas, y ha servido para correlacionar la estructura de estas sustancias con aspectos evolutivos.
Para una revisión sobre el origen y la biosíntesis de esteroles de esponjas marinas puede consultarse el artículo de Djerassi y Silva3. Para procedimientos de síntesis química análogos a la ciclización del escualeno consultar el trabajo de Zoretic y col.4
Hechos estructurales
Los esteroles naturales conocidos presentan las siguientes características estructurales: a. Los enlaces dobles en el núcleo se presentan principalmente en C-5, C-7, C-8 y C-9. b. Los enlaces dobles en la cadena lateral se presentan especialmente en C-22, y con menor frecuencia en C-24 y C-25. c. Además de los grupos metilos 18, 19, 21, 26 y 27, es frecuente encontrar grupos metilo en C-24, menos frecuente en el C-4. d. La cadena lateral presenta grupos alquilo (metilo, etilo, isopropilo, propilo, etc.) principalmente en C-24. e. Algunos organismos poco evolucionados (invertebrados marinos, orquídeas, etc.) presentan esteroles con modificaciones en la cadena lateral (anillos ciclopropano, dobles enlaces alénicos, metilaciones en C-26 y C-27, ausencia del C-25, etc.), y con núcleos modificados (ver Figura 2)5.
Métodos de análisis
Existen varios métodos de análisis. Extracción. Separación y purificación. Identificación.
Extracción
El método más utilizado para la extracción de esteroles libres y esterificados es el de Bligh y Dyer. El tejido vegetal seco y molido se extrae a temperaturas menores de 40°C, con un volumen suficiente de una mezcla Cloroformo:Metanol 2:1. Toda esta mezcla se filtra y al filtrado obtenido se le hace partición con un volumen adecuado de agua. La fase clorofórmica contiene entonces todos los compuestos liposolubles tales como esteroides, triglicéridos, otros terpenoides, ácidos grasos, etc.
Cuando se sabe de antemano que la muestra contiene glicósidos esteroides, y se desea estudiar sus respectivas agliconas, entonces el material vegetal se extrae con alcohol o con una mezcla alcohol:agua, y el extracto obtenido se hidroliza con HCl 2M.
Existe un procedimiento a escala industrial para la obtención del colesterol de médula de bovinos. Así mismo se ha descrito un proceso de obtención de los fitosteroles a partir de la "cachaza" de la caña de azúcar.
Separación y purificación
Para la separación y purificación de esteroles a partir de extractos lipídicos, se emplean con buenos resultados la Cromatografía en Columna y la Cromatografía en Capa Fina (CCF), con sílica gel y eluentes como mezclas de n-hexano-acetato de etilo, y mezclas de ellos. Una mezcla recomendable es n-Hexano-Acetato de etilo 4:1. Existen varias clases de reveladores incluido el de Liebermann-Burchard, uno con cloruro de berberina y carbazol-ácido sulfúrico.
Sin embargo, no siempre estas técnicas en forma aislada permiten la obtención de esteroles puros, sobretodo en el caso de mezclas de esteroles, por lo cual deben complementarse con otras técnicas de separación y purificación más eficientes como son: La CCF Argéntica (placas de sílica gel impregnadas con una solución de nitrato de plata al 10% en acetonitrilo), la Cromatografía Líquida de Alta Eficiencia (CLAE o HPLC en inglés) y la Cromatografía de Gases (CG).
Métodos de identificación
- Ensayo de Liebermann-Burchard
- Espectroscopía infrarrojo
- Espectrometría de resonancia magnética nuclear protónica
- Espectrometría de masas de impacto electronico
- Espectroscopía ultravioleta
- Espectrometría de resonancia magnética nuclear de carbono-13
Ensayo de liebermann-burchard
Los esteroles se pueden reconocer fácilmente en los análisis fotoquímicos preliminares de muestras vegetales y animales mediante el ensayo de Liebermann-Burchard. En este ensayo, a una solución clorofórmica de la muestra que se analiza, se le agrega un volumen igual de anhídrido acético y una gota de ácido sulfúrico concentrado (98%). Si hay esteroles, se producen coloraciones verdes, violetas, rojas o azules.
Aunque no se conoce el mecanismo de esta prueba, es muy utilizada. Algunos autores aseguran que la dan positiva solamente los esteroles que tengan en su estructura grupos dieno conjugados reales o potenciales (por ejemplo en los D5-3- hidroxiesteroides la deshidratación genera un D3,5 dieno). Existen otras pruebas de coloración para el reconocimiento de esteroides, pero son menos utilizadas debido al gran desarrollo de las técnicas instrumentales. Para estas pruebas puede consultarse el libro de Domínguez12.
Espectroscopia infrarrojo
Los espectros infrarrojo de la mayoría de esteroles naturales son bastante simples y similares a los de alcoholes alifáticos saturados o insaturados. Generalmente se observan: Una banda de tensión O-H alrededor de 3600 cm-1, bandas de tensión de enlaces C-H saturados alrededor de 2960-2780 cm-1, bandas de tensión de enlaces =C-H alrededor de 3125-3030 cm-1, bandas de flexión de enlaces saturados C-H alrededor de 1440 y 1380 cm-1 y bandas de tensión de enlaces C=C olefínicos alrededor de 1670 cm-1 (Generalmente es una banda débil que a veces no se observa). Existe una colección de espectros infrarrojo de esteroles. Una aplicación interesante de la espectroscopía infrarrojo es que permite diferenciar por ejemplo entre los ésteres de esteroles y otros tipos de sustancias como los triglicéridos y los fosfolípidos.
Espectrometría de resonancia magnética nuclear protónica
Los espectros de resonancia magnética nuclear protónica de los esteroles deben ser preferiblemente de alta resolución (220, 360 MHz, etc.), debido al número y clases de protones que contienen. En forma general se observan las señales de protones metílicos en la región de 0-1 ppm con constantes de acoplamiento de 6- 7 Hz cuando tienen carbonos saturados vecinos. El protón ligado al carbono 3 se observa a 360 MHz como un "heptete" alrededor de 3.53 ppm cuando el hidroxilo está en posición 3b, mientras que se observa como un "quintete" cuando el hidroxilo está en posición 3a.
En el caso de los esteroles con enlace doble entre los carbonos 5 y 6, el protón del carbono 6 se observa como un "doblete" ancho alrededor de 5.35 ppm.
En el caso de esteroles con enlaces dobles en C-5 y C-7 (esteroles con núcleo tipo ergosterol) los protones H-6 y H-7 se observan como multipletes en 5.4 y 5.5 ppm.
En el caso de los derivados acetilados de esteroles, la presencia del grupo acetato sobre el carbono 3, desplaza la señal del protón ligado al mismo carbono hasta valores de 4.5 ppm, además en el espectro aparece la señal del grupo metilo del acetato alrededor de 1.8 ppm. La región de protones metílicos (0-1.2 ppm) es conocida para varios esteroles naturales, y permite asignaciones estereoquímicas precisas de la cadena lateral.
Espectrometría de masas de impacto electronico
Los espectros de masas de impacto electrónico (70 eV) de los esteroles libres proporcionan buena información estructural y existen mecanismos de fragmentación verificados experimentalmente con esteroles marcados con isótopos tales como deuterio.
Teniendo en cuenta que la mayoría de esteroles naturales poseen 4 clases de núcleos tetracíclicos: ∆5-3-Hidroxiandrosteno, ∆0-3-Hidroxiandrostano, ∆7-3- Hidroxiandrosteno, ∆5,7-3-Hidroxiandrostadieno y ∆5,7,9(11)-3- Hidroxiandrostatrieno (Figura 5), y que muchos de ellos tienen cadenas laterales hidrocarbonadas saturadas o monoinsaturadas en los carbonos 22, 24 o 25; pueden establecerse características estructurales a partir de su espectro de masas I.E.
Espectroscopia ultravioleta
Debido a que la mayoría de esteroles naturales contienen grupos funcionales tales como enlaces dobles C=C y el grupo hidroxilo, sus espectros ultravioleta en metanol (200-360 nm) únicamente muestran un máximo de absorción alrededor de 205 nm, debido a transiciones p-p* del enlace doble aislado. Sin embargo, para esteroles con grupos dienos conjugados como por ejemplo el ergosterol, estos sí absorben intensamente en la región citada y la posición de los máximos de absorción se puede predecir con las reglas de Woodward-Fieser para dienos conjugados. Por ejemplo, los esteroles con núcleo ∆5,7-3-hidroxiandrostadieno presentan máximos de absorción alrededor de 240, 270, 280 y 290 nm, mientras que los esteroles con núcleo ∆5,7,9(11)-3-hidroxiandrostatrieno presentan máximos de absorción alrededor de 310, 325 y 340 nm19. Los esteroides con el cromóforo ∆4-3-oxa muestran un máximo característico alrededor de 240 nm.
Espectrometría de resonancia magnética nuclear de carbono-13
El gran desarrollo de la Espectrometría de Resonancia Magnética Nuclear de carbono-13 en los últimos años, ha hecho que esta técnica desplace a otras en la elucidación estructural de esteroides. Es muy fácil reconocer en estos espectros las señales características de esteroles como por ejemplo, la señal del carbono 3 aparece alrededor de 72 ppm en esteroles con núcleos D5- y D7-3-hidroxiandrosteno20. Además, los esteroles con núcleo D5-3-hidroxiandrosteno presentan las señales de los carbonos 5 y 6 en 141 y 122 ppm aproximadamente, la señal del metilo 18 a 12 ppm, y la del metilo 19 a 20 ppm. Los esteroles con núcleo D7-3- hidroxiandrosteno muestran las señales de los carbonos 7 y 8 a 130 y 140 ppm, y las señales de los metilos 18 y 19 alrededor de 12 ppm aproximadamente. La tabla 421 resume los desplazamientos químicos aproximados para varios tipos de carbonos característicos de los esteroides naturales.
Nomenclatura iupac de 3-hidroxiesteroides
Aunque a la mayoría de esteroles conocidos se les conoce por sus nombres vulgares (P.ej. colesterol, estigmasterol, ß- sitosterol, brassicasterol, coprosterol, etc.) la IUPAC tiene una forma más sistemática para llamar a todas estas clases de sustancias. Para ello, considera a la mayoría de esteroles relacionados con la estructura del colestano. El nombre IUPAC consta de cuatro partes: - el esqueleto básico - la posición de las insaturaciones - la posición del grupo hidroxilo - la estereoquímica Por ejemplo veamos el nombre IUPAC del colesterol: El esqueleto básico es el del colestano entonces: COLEST Tiene un enlace doble sobre el carbono 5, entonces: 5-én- Tiene un grupo hidroxilo sobre el carbono 3, entonces: 3-OL Y por lo tanto el nombre correcto es: Colest-5-én-3-ol Cuando el esterol posee más de un enlace doble se escribe COLESTA en vez de COLEST. Cuando posee 2, 3, 4, etc. enlaces dobles se dice: DIEN, TRIEN, TETRAEN, etc. Cuando posee 2, 3, 4, etc. grupos hidroxilos se dice: DIOL, TRIOL, TETRAOL, etc.
Cuando posee sustituyentes29, estos se nombran como prefijo del esqueleto básico, p.ej. 24-METILCOLEST, 24- ETILCOLEST, etc.
Veamos ahora cuál es el nombre IUPAC para el ergosterol:
24-METILCOLESTA-5,7,22-TRIEN-3-OL
Los sufijos dependen del grupo más oxidado, p. ej. el carbonilo es un sufijo preferible frente a un grupo hidroxilo.
Los esteroles que posean un anillo contraído, por ejemplo algunos esteroles marinos en los cuales el anillo A es de 5 carbonos, se les denomina noresteroles, por ejemplo: A-Norcolesterol. Los que poseen un anillo expandido se les denomina homo-esteroles. Los esteroles con un enlace roto o ausente en alguno de los anillos se los denomina seco-esteroles.
Sin embargo, hasta ahora no se ha incluido en el nombre IUPAC algo tan importante como es la estereoquímica. Para lograr esto, basta con añadir luego del número correspondiente las letras R, S, E, Z, a ó ß, según se trate de epímeros R o S, isómeros E o Z o configuraciones a ó ß, respectivamente.
Generalmente, los esteroles naturales poseen la configuración 3ß-hidroxi, siendo pocas las excepciones. Cuando no se conoce la estereoquímica del C-24 se utiliza la letra griega x.
Veamos por ejemplo, cuál será el nombre IUPAC para el estigmasterol tal como aparece su estructura en la Figura 2:
(24S)-24-ETILCOLEST-7,22E-DIEN-3b-OL
Y si no se conociera la estereoquímica en C-24 se llamaría:
24x-ETILCOLEST-7,22E-DIEN-3b-OL
Actividad fisiológica, síntesis y degradación microbiológica de esteroles
Aunque a los esteroles naturales no se les conocen actividades biológicas específicas fuera de las funciones biológicas citadas al principio, se ha reportado la acción antipirética en conejos del 24-Etilcolesta-7,22-dien-3ß-ol (asterosterol) presente en el ajenjo Artemisia absinthium, Compositae; y se han reportado esteroles citotóxicos, especialmente esteroles oxigenados en la cadena lateral como los siguientes aislados de un alga roja30, otros polihidroxiesteroides de corales blandos presentan acción citotóxica. Menos estudiados son los esteroides diméricos y oligoméricos, pero algunos son interesantes como las cefalostatinas, ya que son altamente citotóxicas y por lo tanto son agentes antitumorales potenciales32.
En el caso de esteroles con el núcleo D5,7-3-hidroxiandrostadieno como el ergosterol, estos son convertidos en vitamina D la cual desempeña un papel importante en el metabolismo de minerales como el calcio y fósforo, y esta puede ser convertida en otros análogos hidroxilados que son activos contra la psoriasis y cáncer de tipo epitelial. Algunos esteroles con grupos funcionales peróxido y epóxido, como loas aislados del micelio del hongo Cordyceps sinensis, presentan actividad antitumoral.
Pero hasta ahora la mayor importancia de los esteroles naturales es para la industria farmacéutica, en especial la dedicada a la producción de medicamentos esteroides. La Figura 9 esquematiza el proceso de conversión mediante reacciones de síntesis química y procesos de fermentación, del estigmasterol en medicamentos fluorocorticoides, la figura 10 muestra el proceso de conversión de sitosterol y colesterol en esteroides acetilénicos y la figura 11 esquematiza el proceso de hormonas esteroides a partir de los esteroles de la caña de azúcar35.
Es interesante también anotar que el lanosterol presente en la lana de ovejas puede ser convertido en 14a-metilprogesterona36. La conversión de la funcionalidad 5-en-3-ol tan característica de esteroles con el núcleo tipo colesterol, en la funcionalidad 5-en-3-ona puede hacerse mediante la denominada reacción de Oxidación de Oppenauer37, o en algunos casos por oxidación con KMnO4 y CuSO4 , obteniéndose además esteroides bioactivos 6- hidroxilados38.
Referencias
- Varkony T.H., Smith D.H., Djerassi C., TETRAHEDRON 34, 841 (1978).
- Phytochemistry 40 (6) 1585 (1995)
- Djerassi C., Silva C.J., ACC. CHEM. RES. 24, 371 (1991).
- Zoretic, P. A. y col.; TETRAHEDRON LETT. 37 (44) 7909 (1996).
- Duque, C.; Martínez, A.; Peñuela, G.; REV. COL. QUIM. 12(1) 51 (1983).
- Padilla, A. y col.; REV. CUB. FARM. 8, 3-19 (1974).
- Navía, D. A.; REV. CUB. FARM. 4, 27-35 (1970)
- a) Williams, C. M., Mander, L. N., TETRAHEDRON 57, 425 (2001); b) Wilson, R., Sargent, J. R.,J. CHROMATOG. A 905, 251-257 (2001).
- Ikekawa N., Fujimoto Y., Kadota S., Kikuchi T., J. CHROMATOG. 468, 91 (1989).
- Martínez, A., Duque, C., Resultados sin publicar.
- Popov, S.; Carlson, R. M. K., Weggmann, A.; Djerassi, C.; STEROIDS 28, 699 (1976).
- Domínguez, X. A.; "Métodos de Investigación Fitoquímica". Ed. Limusa, México, 1979.
- Kisner H.J., Brown C.W., Kavarnos G.J., ANAL CHEM. 54, 1479 (1982).
- Budzikiewicz et al., "Mass Spectrometry of Natural Products", Vol. II: Steroids; Holden-Day,San Francisco, 1964. b) J. ORG. CHEM. 42 (4) 725 (1977). c) J. ORG. CHEM. 46 954 (1981). d) J.AMER. CHEM. SOC. 102 (2) 807 (1980). e) REV. LATIN. QUIM. 15 (3) 107 (1984). f) PURE APPL.CHEM. 50, 171 (1978). g) J. AMER. CHEM. SOC. 100, 7677 (1978). h) BULL. SOC. CHIM. BELG.87 (7) 539 (1978). i) TETRAHEDRON 44 (5) 1359 (1982).
- Galli G., Maroni S., STEROIDS 10(3) 189 (1967).
- Http//:huitoto.udea.edu.co/~farmacogfit
- Varkony, T. H., y col., TETRAHEDRON 34, 841 (1978).
- Galli G., Maroni S., STEROIDS 10(3) 189 (1967).
- Http//:huitoto.udea.edu.co/~farmacogfit
- Varkony, T. H., y col., TETRAHEDRON 34, 841 (1978).
- Notaro, G. y col.; J. NAT. PROD. 55 (11) 1588-1594 (1992).
- Djerassi C, Romo J., Rosenkranz G., J. ORG. CHEM. 16, 754 (1951).
- Nota: Rehman y col. reportan que si el desplazamiento químico del C-3 es alrededor de 77 ppm,este es un indicio de un esterol con un carbohidrato ligado a través del C-3. (Rehnan, A-U. y col.,PHYTOCHEMISTRY 45 (8) 1721 (1997).
- Kalinowski, H-O.; Berger, S.; Braun, S.; "Carbon-13 NMR Spectroscopy", John Wiley & sons,Chichester-New York-Brisbane, 1984, pp. 434.
- Wright J.L.C., McInnes A.G., Shimizu S., Smith D.G., Walter J.A., Idler D., Khalil W., CAN. J.CHEM. 56, 1898-1903 (1978)
- Prakash O., et al. J. NAT. PROD. 52(4) 686 (1989).
- Desai U.R., Trivedi G.K., J. ORG. CHEM. 56, 4625 (1991).
- Akihisa T., Matsumoto T., ABURA KAGAKU 36, 301-320 (1987).
- Smith, L. L., y col.; STEROIDS 58 (6) 260-267 (1993).
- J. NAT. PROD. 55(2) (1992).
- Robinson, T.; "The Organic Constituents of Higher Plants", Cordus Press, North Amherst MASS,1983.
- En orden de prioridad: alquilos>haluros>nitro, pero los dos últimos no se encuentran presentes en esteroles de origen natural. En el caso de los esteroles sintéticos que poseen heteroátomos conformando alguno de los anillos, se los nombra con los prefijos aza, tia u oxa, según si el heteroátomo involucrado es N, S u O, respectivamente.
- Sheu, J-H. et al.; J. NAT. PROD. 59, 23-26 (1996).
- Koljak, R. y col., TETRAHEDRON 54, 179 (1998).
- Li, Y., Dias, J.R., CHEM. REV. 97, 283 (1997).
- Zhu, G-D.; Okamura, W.H.; CHEM. REV. 95 (6) 1877 (1995).
- Bok, J. W., y col., PHYTOCHEMISTRY 51, 891-898 (1999).
- Navía, D. A.; REV. CUB. FARM. 4, 27-35 (1970).
- Pettit, G. R.; J. NAT. PROD. 59 (8) 812-821 (1996).
- Sica D., Zollo F., TETRAHEDRON LETT. (9) 837 (1978).
- Parish, E. J., J. ORG. CHEM. 61, 5665-6 (1996).
- Kobayashi, M. y col., STEROIDS 40(6) 673 (1982).
Fuentes
- B. Pavlov, A Terrrentiev. Curso de Química Orgánica, traducido por Victoria Valdez Mendoza, Editorial Mir Moscú, 1970, pag. 549.
- Martínez Martínez, Alejandro.(2002). ESTEROLES, Facultad de Química Farmacéutica, UNIVERSIDAD DE ANTIOQUIA, Medellín, Abril de 2002. Disponible en: http://farmacia.udea.edu.co/~ff/esteroles2001.pdf