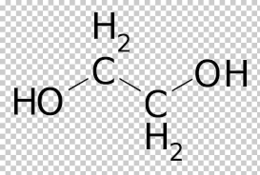
Etilenglicol
| ||||||
Etilenglicol. Conocido también por 1,2-etanodiol, glicol de etileno ó simplemente glicol es el diol más simple. Fue preparado por primera vez por Wurtz en 1859 y es usado como agente anticogelante en el sistema de refrigeración del automóvil.
Sumario
Obtención
Fue obtenido por primera en [1859] por el químico francés Charles-Adolphe Wurtz (1817-1884). Preparó el primer etilenglicol en 1856. Primero trató el "yoduro de etileno" (C2H4I2) con acetato de plata y luego hidrolizó el "diacetato de etileno" resultante con hidróxido de potasio. Wurtz nombró su nuevo compuesto como "glicol" porque compartía cualidades tanto con el alcohol etílico (con un grupo hidroxilo) como con la glicerina (con tres grupos hidroxilo). En 1859 Wurtz preparó etilenglicol a través de la hidratación del óxido de etileno.
Se obtiene por adición de agua al óxido de etileno. En el proceso industrial de fabricación se hace reaccionar el óxido de etileno con agua en exceso para evitar la formación de polímeros (10 veces en exceso molar), según la siguiente ecuación química:
C2H4O + H2O → HOCH2CH2OH
Esta reacción puede ser catalizada mediante ácidos o bases, o puede ocurrir en un pH neutro a temperaturas elevadas. La mayor producción de etilenglicol se consigue con un pH ácido o neutro en presencia de abundante agua. Bajo estas condiciones, se puede obtener una productividad del 90%. Los principales subproductos obtenidos son dietilenglicol, trietilenglicol, y tetraetilenglicol.
Se puede obtener mediante el tratamiento de 1,2-dibromoetano con acetato de plata dando diacetato de etilenglicol, que a continuación se hidroliza al etilenglicol.
El etilenglicol se utilizó por primera industrialmente en lugar de glicerol durante la Primera Guerra Mundial como un intermedio para explosivos (dinitrato de etilenglicol), pero desde entonces se ha convertido en un importante producto industrial.
La capacidad mundial para la producción de etilenglicol a través de la hidrólisis de óxido de etileno se estima en alrededor de 700 toneladas al año.
Características
El etilenglicol es un compuesto químico orgánico que pertenece al grupo de los dioles. Es un líquido transparente, incoloro, inodoro, de sabor dulce. Es higroscópico y completamente miscible con muchos disolventes polares, tales como el agua, alcoholes, éteres de glicol, y acetona. Sin embargo, su solubilidad es baja en solventes no polares, tales como el benceno, tolueno, dicloroetano, y cloroformo.
Su nombre deriva del griego glicos (dulce) y se refiere al sabor dulce de esta sustancia. Por esta propiedad ha sido utilizado en acciones fraudulentas intentando incrementar la dulzura del vino sin que el aditivo fuera reconocido por los análisis que buscaban azúcares añadidos. Sin embargo es tóxico y produce disfunción renal.
A temperatura ambiente es poco volátil, pero puede existir en el aire en forma de vapor. Se fabrica a partir de la hidratación del óxido de etileno (epóxido cancerígeno).
Propiedades físicas
- Punto de ebullición a 101,3 kPa 197,60 ºC
- Punto de fusión -13,00 ºC
- Densidad a 20 ºC 1,1135 g / cm3
- Índice de refracción, nD20 1,4318
- Calor de vaporización a 101,3 kPa 52,24 kJ / mol
- Calor de combustión 19,07 MJ / kg
- Temperatura crítica 372ºC
- Volumen crítico 6515,73 kPa
- Presión crítica 0.186L / mol
- Punto de inflamabilidad 111ºC
- Temperatura de ignición 410ºC
- Límite explosivo inferior 3,20 vol%
- Límite explosivo superior 53vol%
- Viscosidad a 20 ºC 19.83 mPa • s
- Coeficiente de dilatación cúbica a 20ºC 0,62 × 10-3 K-1
El etilenglicol es difícil de cristalizar; cuando se enfría, se forma una masa altamente viscosa subenfriada, que finalmente solidifica para producir una sustancia semejante al vidrio.
Propiedades químicas
Al igual que otros alcoholes el etilenglicol se somete a las reacciones típicas de sus grupos hidroxilo. Aquí sólo consideraremos las características químicas especiales y reacciones industrialmente importantes del etilenglicol. Los dos grupos hidroxilo adyacentes permiten la ciclación, y la policondensación; uno o ambos de estos grupos funcionales pueden, por supuesto, también reaccionan para dar otros derivados.
Oxidación
El etilenglicol se oxida fácilmente por el oxígeno, ácido nítrico, y otros agentes oxidantes para formar un número de aldehídos y ácidos carboxílicos. Los productos típicos derivados de las funciones alcohólicas son glicolaldehıdo (HOCH2 CHO), ácido glioxílico (HOCH2COOH), glioxal (CHOCHO), ácido glioxílico (HCO- COOH), ácido oxálico (HOOCCOOH), formaldehído (HCHO) y ácido fórmico (HCOOH).
La variación de las condiciones de reacción puede conducir a la formación selectiva de un producto de oxidación deseado.
La oxidación en fase gaseosa con aire en presencia de catalizadores de cobre es de importancia industrial para la producción de glioxal. Escisión glicol se produce en solución ácida con agentes oxidantes cier- tos tales como el permanganato, peryodato, o tetracetato de plomo. La ruptura del enlace C-C produce principalmente formaldehído, parte del cual se oxida adicionalmente a ácido fórmico.
Aplicaciones
El etilenglicol se utiliza principalmente como un anticongelante en radiadores de automóviles como difusor del calor, mezclado con agua para los procedimientos de deshielo y antihielo de los aviones comerciales, para fabricar compuestos de poliéster, y como disolvente en la industria de la pintura y el plástico.
Es también un ingrediente en líquidos para revelar fotografías, fluidos para frenos hidráulicos y en tinturas usadas en almohadillas para estampar, bolígrafos, y talleres de imprenta y como materia prima para la fabricación de fibras de poliéster.
El uso generalizado de etilenglicol como anticongelante se basa en su capacidad para reducir el punto de congelación cuando se mezcla con agua. Las propiedades físicas de mezclas de agua-etilenglicol son, por lo tanto, extremadamente importantes.
Se utiliza en soluciones para deshelar aviones y barcos.
Tiene gran uso como materia prima para la fabricación de fibras de poliéster.
Glicol
Los glicoles (HO-CH2CH2-OH) son un tipo de compuesto químico que contiene dos grupos hidroxilos (grupos -OH) que resultan de la reacción del agua con el óxido de etileno. En general, todos los glicoles se presentan en forma de líquido claro, transparente, inodoro y de baja volatilidad.
El glicol se utilizó por primera vez industrialmente en lugar de glicerol durante la Primera Guerra Mundial como un intermedio para explosivos (dinitrato de etilenglicol), pero desde entonces se ha convertido en un importante producto industrial.
La capacidad mundial para la producción de etilenglicol a través de la hidrólisis de óxido de etileno se estima en alrededor de 700 toneladas al año.
En la industria del poliuretano flexible estos productos tienen una denominación general y son llamados poliol. El glicol se utiliza como aditivo anticongelante para el agua en los radiadores de motores de combustión interna, es el principal compuesto del líquido de frenos de vehículos y también es usado en procesos químicos como la síntesis de los poliuretanos, de algunos poliésteres, como producto de partida en la síntesis del dioxano, la síntesis del glicolmonometileter o del glicoldimetileter, como disolvente, etc.
Efectos para la salud
La ingestión de cantidades muy altas de etilenglicol puede causar la muerte, en tanto que cantidades mínimas pueden producir náusea, convulsiones, dificultad para hablar, desorientación, y problemas en el corazón y el riñón. Los animales hembras que sufrieron esta intoxicación por grandes cantidades de etilenglicol tuvieron crías con defectos de nacimiento, mientras que los animales machos experimentaron una disminución en el número de espermatozoides. Sin embargo, estos efectos se observaron a niveles muy altos y no se espera que ocurran en personas expuestas a niveles menores en sitios de residuos peligrosos.
El etilenglicol afecta a la química del organismo aumentando la cantidad de ácido, lo que produce problemas metabólicos. La intoxicación se presenta como depresión del sistema nervioso central e irritación en el sitio de absorción inicialmente, seguido de acidosis metabólica e hipocalcemia.
Puede causar sordera, ceguera y puede dejar grandes secuelas cerebrales, y a grandes dosis producir la muerte.
Es un disolvente orgánico con actividad nefrotóxica como se mencionó anteriormente. Puede ocasionar necrosis tubular aguda que si no se trata a tiempo, puede desencadenar una insuficiencia renal crónica y posteriormente la muerte.
Si es absorbido por el tracto digestivo provoca intoxicacióny puede acarrear vómitos, hiperventilación, acidosis metabólica, disfunción cardiovascular e insuficiencia renal aguda.
Efectos ambientales
El etilenglicol utilizado para el deshielo de aeronaves se vierte directamente al medio ambiente. Un informe elaborado por la Organización Mundial de la Salud en el 2015 mostró efectos tóxicos en organismos acuáticos expuestos en el laboratorio a una corriente de agua proveniente del alcantarillado de un aeropuerto.
Los estudios de campo en las cercanías de un aeropuerto también signos tóxicos consistentes con envenenamiento por etilenglicol, muerte de peces, y reducción de la biodiversidad, aunque esos efectos no pueden ser atribuidos con total certeza al etilenglicol.
El proceso de biodegradación de los glicoles también aumenta el riesgo para los organismos, conforme los niveles de oxígeno se agotan en las aguas superficiales. Otro estudio halló una toxicidad relativamente baja para los organismos acuáticos, pero el efecto de agotamiento del oxígeno resulta ser más grave.
Además, «la biodegradación anaeróbica también puede liberar subproductos relativamente tóxicos, tales como el acetaldehído, etanol, acetato, y el metano»."