Fitoplasma
| ||||||
Fitoplasmas. Fitopatógenos que difieren sustancialmente de otros grupos dentro de la clase "Mollicutes", que reúne a los procariotas sin pared celular(Seemuller y col., 1994; Gundersen y col., 1994; Razin y col., 1998).
Sumario
Reseña histórica
Desde hace muchos años están descritas, en varias especies de plantas pertenecientes a diversas familias vegetales, enfermedades caracterizadas por la manifestación de un conjunto síntomas entre los que se destacan el amarilleamiento foliar, el reverdecimiento de las estructuras florares dando aspecto de hojas, la proliferación exagerada de brotes y el raquitismo de la planta.
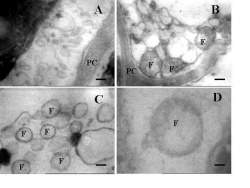
En un principio se pensó, sin evidencias concretas, que eran virus fitopatógenos los causantes de estos síntomas. Los experimentos dirigidos a esclarecer la identidad del agente causal fallaron hasta 1967. En esta fecha un grupo de científicos japoneses observaron, mediante microscopía electrónica de cortes ultra finos de tejido floemático de plantas que manifestaban amarilleamiento, organismos amorfos no helicoidales y carentes de pared celular, que fueron llamados en un principio “Organismos Parecidos a los Micoplasmas” (Doi y col., 1967). Esta denominación se mantuvo hasta 1994 cuando fue propuesto el término actual de Fitoplasmas para designar a estos fitopatógenos que diferían sustancialmente de otros grupos dentro de la clase "Mollicutes", que reúne a los procariotas sin pared celular.
Formas de conservación
Debido a la imposibilidad de mantenerlos en cultivos puros por ser parásitos intracelulares obligados, son conservados en cultivo de células vegetales del hospedero o mediante inoculaciones seriadas de plantas susceptibles, utilizando injertos o insectos vectores. Son resistentes a los antibióticos que actúan interfiriendo la síntesis de la pared celular, pero notablemente sensibles a las tetraciclinas que actúan en la síntesis proteica. Su localización se hace casi exclusiva a la savia de los tubos cribosos del floema.
Daños económicos y distribución geográfica
Cientos de especies de vegetales son afectadas por los fitoplasmas. Su impacto económico sobre diversos cultivos se extiende a varias áreas geográficas; en Australia se reportan pérdidas en el rendimiento entre un 13 y 54 % en viñedos severamente afectados por fitoplasmas , Europa reporta incidencias de estas enfermedades en el cultivo de la papa de un 86 % con considerábles pérdidas en el rendimiento agrícola, en Francia se reportaron en ciertas parcelas afectaciones entre el 30 y el 90 % de las plantas de tabaco, durante los años de mayor incidencia.
Dispersión y desarollo
La dispersión y el desarrollo de las fitoplasmósis están influenciados por la densidad de inóculo y por la actividad de los vectores. Por este motivo el conocimiento de los vectores potenciales y las fuentes de inóculo es necesario para predecir el riesgo de nuevas infecciones (en uno o múltiples cultivos) con vistas al monitoreo del progreso de las enfermedades, y para desarrollar métodos de control.
Epifitiología de las fitoplasmosis
En las fitoplasmosis se pueden identificar los siguientes eslabones de la cadena epifitiológica: Agente etiológico, reservorio natural, vía de trasmisión y hospederos susceptibles. Los fitoplasmas constituyen los agentes causales y se diferencian en 14 grupos fundamentales a raíz del análisis de los coeficientes de similitud de los patrones de RFLP obtenidos a partir de los ADNr 16S.
Sin embargo esta clasificación no se corresponde del todo con el rango de hospederos que cada grupo, o representante de él, puede infectar (al menos experimentalmente). Se conoce además que diferentes fitoplasmas causan síntomas idénticos en algunas plantas y que por otro lado algunos fitoplasmas muy emparentados causan síntomas diferentes en las mismas plantas hospederas.
Reservorio natural
El reservorio natural de los fitoplasmas está constituido por algunas malezas y entre las más citadas para los fitoplasmas causantes del “Stolbur” del tabaco se encuentra la Campanilla o Corregüela silvestre (Convolvulus arvensis L.) y Nicotiana Glauca. Por ser completamente dependientes de sus hospederos para sobrevivir; su vía de trasmisión, a nuevas áreas, es mediante transplantes de semilla agámica infectada, injertos, plantas parásitas como la cúscuta o “bejuco de fideo” (Cuscuta sp) y por insectos vectores. No se trasmiten mecánicamente.
Agentes transmisores
En condiciones naturales los principales responsables de la trasmisión de los fitoplasmas son insectos picadores-chupadores que se alimentan de la savia del floema que pertenecen a los Hemípteros Sternorrhyncos, a los Euhemípteros y a los Neohemípteros. Son vectores de fitoplasmas los cicadélidos o “salta hojas” (en particular la familia Jassidae), los Fulgoromorfos o “salta matas” (en particular la familia Cixiidae) y la familia Psyllidae (psílidos) (Cousin y Boudon-Padieu, 2002).
Estudios realizados muestran que el rango de hospederos vegetales susceptibles de padecer fitoplasmosis está en relación con los hábitos alimentarios de los vectores (ya sean éstos mono, oligo o polífagos). Por otra parte se plantea que los ataques más severos a las plantas cultivadas parecen ocurrir cuando las condiciones climáticas (altas temperaturas, sequías y vientos) obligan a los vectores a migrar desde sus hospederos y reservorios silvestres hacia los cultivos que de otra manera no atacarían.
Descripción de la situación en Cuba
En nuestros campos se ha reportado la presencia de cicadélidos asociados a cultivos donde hay manifestación de los síntomas que producen los fitoplasmas.
Por otra parte, las condiciones ambientales de altas temperaturas medias anuales y sequía que imperan en todo nuestro territorio, propician la migración de los insectos desde sus reservorios naturales hasta las plantaciones alternativas de valor económico donde encuentran plantas más suculentas de quienes extraen con más eficiencia la savia con sus aparatos bucales de tipo picador-chupador.
Por último, en Cuba se han detectado fitoplasmas afectando diversos cultivos de interés entre los que resaltan la caña de azúcar (Saccharum officinarum), el maíz (Zea mays), la frutabomba (Carica papaya), el coco (Cocos nucifera) y la vicaria blanca (Catharantus roseus) (Arocha y col.
Situación en el cultivo del tabaco
Como se ha visto, en nuestro país se encuentran todos los eslabones de la cadena epifitiológica de las fitoplasmosis así como los factores ecológicos favorables para el desarrollo de esta enfermedad en diversos cultivos. Esta situación deviene en una alerta para la agricultura tabacalera debido a que Nicotiana tabacum es sensible a los fitoplasmas de diversos grupos como ha quedado demostrado en estudios experimentales.
Por todo lo anterior, no debe descartarse la posibilidad de que ya se encuentren los fitoplasmas en las áreas tabacaleras y aún no se hayan reportados. Esta suposición se sustenta sobre la base de que los estudios de detección de estos fitopatógenos y sus vectores en este cultivo no han sido realizados, y que el nivel de conocimiento sobre esta enfermedad por parte de los productores es mínimo.
Además, es muy probable que existan plantas enfermas y no sean notificadas debido a que los síntomas que estos agentes provocan, se pueden confundir con el efecto de tratamientos herbicidas, deficiencias minerales o virosis, tal como plantean Cousin y Boudon-Padieu en el 2001. Este fenómeno se puede estar manifestando en el caso de la enfermedad denominada “Falso Orobanche”, que afecta al tabaco cubano, de la que no se conoce su agente causal.
Ésta enfermedad se manifiesta en Cuba como un crecimiento anormal de los tejidos próximos a la base del tallo formando una masa indiferenciada y abultada de células, de la que con posterioridad proliferan brotes de modo exagerado. Se reportan las mayores incidencias en áreas tabacaleras de las provincias orientales.
En diversos países se realizaron estudios para determinar el agente causal de una enfermedad de igual nombre, pero cuya descripción difiere de la que aquí ofrecemos, sin lograr resultados concretos ya que atribuían confusamente la manifestación de los síntomas al posible efecto de Agrobacterium tumefaciens o de Corynebacterium fascians. En el año 2004, Furuya y colaboradores plantearon, en su trabajo sobre la “Agalla de la corona” en tabaco, que el “Falso orobanche” es causado por Rhodococcus fascians.
Como los síntomas que se describen en la literatura internacional para el “Falso orobanche”, causado por R. fascians, difieren de los que se manifiestan en nuestras vegas tabacaleras, y a su vez se asemejan a los que pudiesen causar los fitoplasmas, pudiéramos estar realmente en presencia de una fitoplasmosis.
Fuentes
- Arocha, Y., I. Chávez, M. Quiñones y E.L. Peralta: Detección genérica de fitoplasmas mediante la reacción en cadena de la polimerasa (PCR). Rev. Prot. Veg.14(2): 125-128, 1999..
- Arocha, Y., E.L. Peralta, & P. Jones: Molecular evidences of Aster Yellow as the major phytoplasmic group associated with Sugarcane Yellow Leaf Syndrome (YLS)in Cuba. Rev. Protección Veg. 17(1): 69-71, 2002.
- Arocha, Y., D. Horta, E.L. Peralta, & P. Jones: First report on molecular detection of phytoplasmas in Papaya in Cuba. Plant Dis.. 87 (9): 1148, 2003
- Berges, R., M. Rott, and E. Seemüller: Range of Phytoplasma Concentrations in Various Plant Hosts as Determined by Competitive Polymerase Chain Reaction. Phytopathology, 90(10): 1145- 1152, 2000.
- Bertaccini, A., R.E. Davis, & I.-M. Lee: In vitro micropropagation for maintenance of mycoplasmalike organism in infected plant tissues. Hort. Science, 27(9): 1041-1043, 1992.
- Blancard, D. : Phytoplasme responsable du stolbur des solanées. In: Maladies du tabac. Observer, identifier, lutter. Ed. by Blancard, D. INRA, Paris, 1998.
- Bruner, S., L. Scaramuza y A. Otero: Catálogo de los insectos que atacan a las plantas económicas de Cuba. 60 pp. Academia de Ciencias de Cuba, La Habana, 1945.
- Constable, F., Y. Wilson, M. Kelly, G. Buchanan: Yield trials from Australian grapevine Yellows affected grapevines. In: National program for management of phytoplasma in grapevine. Final report for Grape and Wine Research and Development Corporation, project number CRCV95/2, Chapter 1.2, 1998.
- Cousin, M-T and E. Boudon-Padieu: Phytoplasmes et phytoplasmoses: caractéristiques, symptômes et diagnostic. Cahiers d'études et de recherches francophones / Agricultures,10(6): 361-76, 2001.
- Cousin, M-T and E. Boudon-Padieu: Phytoplasmes et phytoplasmoses: vecteurs, méthodes de lutte et thèmes de recherche. Cahiers d'études et de recherches francophones / Agricultures,11(2): 115-26, 2002.
- Davis, R., and W. Sinclair: Phytoplasma identity and disease etiology. Phytopathology, 88: 1372-1376, 1998.
- Dlavola, J., y N. Novoa: Dos nuevas especies del género Hadria Metcalf y Bruner, (1936) (Homoptera: Auchenorrhyncha) y revisión de otras especies cubanas. Poeyana, 373: 1-19, 1976.
- Doi, Y., M. Teranaka, K. Yora and H. Asuyama: Mycoplasma-or PLT group-like microorganisms found in the phloem elements of plants infected with mulberry dwarf, potato witches’ broom, aster yellows, or paulownia witches’broom. Annals of the Phytopathological Society of Japan, 33: 259-266, 1967.
- Espino, E.: Manual práctico el supervisor agrícola del tabaco. 55 Pág. Agrinfor. La Habana. Cuba. 2002
- Furuya, N., F. Shimokusuzono, Y. Nakamura, K. Nishimura, M. Takeshita, N. Matsuyama, K. Manabe and Y. Takanami: Crown gall of tobacco caused by Agrobacterium tumefaciens biovar 1 in tobacco fields. J Gen Plant Pathol. 70: 39–44, 2004.
- González, G., E. Miranda, J. Fernández, y otros autores: Virus y fitoplasmas en el cultivo del maiz (Zea mays, L) en Cuba: caracterización, distribución y elementos para el control. 2001. Caribbean Division Meeting Abstracts. La Habana, 2001.
- Gundersen, D.E., Lee, I.-M., Rehner, S.A., Davis, R.E., and Kingsbury, D.T. Phylogeny of mycoplasmalike organisms (phytoplasmas): a basis for their classification. J. Bacteriol. 176: 5244-5254, 1994
- Hidalgo-Gato, M., R. Rodríguez-León, N. Ricardo, y H. Feraz.: Dinámica poblacional de cicadélidos (Homóptera: Cicadellidae) en un agro-ecosistema cañero de Cuba. Revista de biología tropical, 47(2): 117- 119, 1999.
- Lauer, U., and E. Seemüller: Physical map of the chromosome of the apple proliferation phytoplasma. J. Bacteriol. 182(5): 1415-1418, 2000.
- Lee I-M., D. Gundersen-Rindal, R. Davis, & I. Bartoszyk: Revised classification scheme of phytoplasmas based on RFLP analyses of 16S rRNA and ribosomal protein gene sequences. International Journal of Systematic Bacteriology, 48: 1153-69, 1998.
- Lee, I-M., D. Gundersen-Rindal, and A. Bertaccini: Phytoplasma: Ecology and genomic diversity. Phytopathology, 88: 1359-1366, 1998.
- Llauger, R., D. Becker, J. Cueto, E. Peralta, V. González, M. Rodríguez, and W. Rohde: Detection and molecular characterization of phytoplasmas associated with Lethal Yellowing Disease of Coconut Palms in Cuba. J. Phytopathology 150: 390-395, 2002
- Lucas, G.: Crown gall. In: Diseases of tobacco, 2nd edn. Scarecrow, New York/London, pp 486–490, 1965.
- Lucas, G.: Diseases caused by mycoplasmalike organism. In: Compendium of tobacco diseases. 45 pp. Ed. by Shew, H.D. and Lucas, G.B. APS Press, St. Paul, MN, 1991.
- Magarey, P., and M. Wachtel: Australians Vine Yellows 1. Inference of a mycoplasma-like aetiology for a new disease of Australian grapevines. 4th International Congress of Plant Pathology, Melbourne, Australia, 1983.
- McCoy R., A. Caudwell, C. Chang, T. Chen, & other authors: Plant diseases associated with mycoplasma-like organisms. In: Whitcomb, R.F., Tully, J.G. (eds.). The Mycoplasmas, 5: 545-640. Academic Press, San Diego, 1989.
- Mendoza, F., y J. Gómez: Principales insectos que atacan a las plantas económicas de Cuba. 304 pp. Pueblo y Educación. La Habana, 1982.
- Razin, S., D. Yogev, Y. Naot: Molecular biology and pathogenicity of mycoplasmas. Micro. Mol. Biol. Rev. 62: 1094-1156, 1998.
- Seemüller E., B. Schneider, R. Mäurer, & 8 other authors: Phylogenetic classification of phytopathogenic mollicutes by sequence analysis of 16S ribosomal DNA. Int. J. Syst. Bacteriol, 44: 440-446, 1994.
- Smith I., D. McNamara, P. Scott, and K. Harris: Quarantine Pests for Europe. In: Data sheets on quarantine pests for the European Communities and for the European and Mediterranean Plant Protection Organization. 1032 pp. Prepared by CABI and EPPO for the European Communities, 1992.
- Tanne E., E. Boudon-Padieu, D. Clair, & other authors. Detection of phytoplasma by polymerase chain reaction of insect feeding medium and its use in determining vectoring ability. Phytopathology, 91: 741-746, 2001.