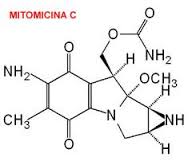
Mitomicina C
| ||||||||||
Mitomicina C. es un producto natural derivado del Streptomyces caespitosus. Contiene grupos aziridina, quinona y uretano.
Sumario
- 1 Mecanismo de acción
- 2 Denominación común internacional
- 3 Composición
- 4 Farmacocinética
- 5 Indicaciones
- 6 Contraindicaciones
- 7 Precauciones
- 8 Reacciones adversas
- 9 Interacciones
- 10 Posología
- 11 Tratamiento de la sobredosis aguda y efectos adversos graves
- 12 Información básica al paciente
- 13 Nivel de distribución
- 14 Regulación a la prescripción
- 15 Clasificación VEN
- 16 Laboratorio productor
- 17 Código ATC
- 18 Fuente
Mecanismo de acción
Actúa como un agente alquilante polifuncional. Reacciona con el ADN y forma enlaces intercatenarios e intracatenarios con dicha molécula (fundamentalmente con guanina y citosina); inhibe la síntesis del ARN y ADN mediante la liberación de radicales libres tipo hidroquinona y semiquinona; degrada el ADN preformado y causa lisis nuclear y formación de células gigantes. Aunque no es fase específica, la mitomicina tiene su efecto máximo en la fase G (tardía) y en la fase S (precoz) del ciclo celular.
Denominación común internacional
Mitomicina.
Composición
Cada bulbo liofilizado contiene 10 mg de mitomicina.
Farmacocinética
Se absorbe escasamente por VO. Se debe administrar por vía IV. Es eliminado rápidamente del plasma después de la administración intravenosa (8-48 min). Tiene amplia distribución. No atraviesa la barrera hematoencefálica. Se metaboliza en el hígado y otros tejidos (bazo, riñones, pulmón y corazón) a través de las enzimas del citocromo P450 y DT-diaforasa, dando lugar a su inactivación. La vía de eliminación es hepatobiliar hacia las heces. Menos de 10 % de la dosis se excreta por la orina. La vida media de eliminación es 50 min.
Indicaciones
Carcinomas epidermoide de ano, canal anal y recto.
Contraindicaciones
Hipersensibilidad conocida a la mitomicina C. Pacientes con depresión de la médula ósea, fundamentalmente con trombocitopenia, trastornos de la coagulación o tendencia incrementada al sangramiento por otras causas.
Precauciones
- LM: se desconoce si es excretado en la leche humana. No obstante, se recomienda suspender la lactancia durante la administración del fármaco.
- Carcinogenicidad: grupo de riesgo 2 B. Evitar la contaminación accidental con los ojos, ya que es muy irritante y puede producir ulceración de la córnea. En caso de que se produzca contaminación accidental, los ojos deben lavarse bien con agua inmediatamente después. Es un fármaco vesicante, por lo que la extravasación puede provocar gran irritación local y celulitis. Se recomienda aplicar bicarbonato sódico en el área afectada y luego inyectar dexametasona. Por la mielosupresión acumulativa se debe monitorear la función hematológica del paciente. No debe continuar tratamiento hasta que el recuento de leucocitos sea mayor que 3 x 109 células/L y el de plaquetas sea mayor que 90 x 109 células/L. El síndrome hemolítico urémico es potencialmente fatal y está correlacionado con dosis totales acumulativas ≥ 60 mg/m². El broncospasmo producido por la combinación con alcaloides de la vinca puede ser manejado de forma eficaz con broncodilatadores, esteroides y/o oxígeno. La función renal debe controlarse antes de comenzar el tratamiento y después de cada ciclo. Debe vigilarse estrechamente los pacientes que reciben radiaciones simultáneamente con la administración de este medicamento, o quienes presenten disfunción hepatobiliar.
Reacciones adversas
Frecuentes
Mielosupresión con leucopenia (nadir entre 24-28 días), anemia, insuficiencia cardiaca (fundamentalmente con dosis mayor que 30 mg/m²), náusea y vómito, anorexia, fiebre, alopecia y trastornos ungueales.
Ocasionales
Rash, estomatitis, parestesia, incremento de los niveles de creatinina, eritema palmar con descamación, disnea, tos, flebitis química, neumonitis intersticial, fibrosis crónica y amenorrea.
Raras
Fallo renal y anemia hemolítica microangiopática, fenómeno de “recuerdo” en los sitios irradiados previamente, encefalopatía aguda, astenia, prurito, reacciones de extravasación y visión borrosa.
Interacciones
- En combinación con los alcaloides de la vinca o la doxorrubicina pueden incrementar la toxicidad cardíaca.
- El uso concomitante de tamoxifeno aumenta la incidencia de anemia, trombocitopenia y del riesgo del síndrome hemolítico urémico.
Posología
- Adultos: en monoterapia, 20 mg/m²/día cada 6-8 semanas; en combinación, 10 mg/m²/día cada 4-6 semanas. El especialista deberá realizar las modificaciones de la dosis del medicamento en relación con la toxicidad hematológica y renal (si el aclaramiento de creatinina es menor que 10 mL/min, deberá administrarse 75 % de la dosis).
Tratamiento de la sobredosis aguda y efectos adversos graves
- La sobredosificación aguda incluye mielosupresión severa (principalmente leucopenia y trombocitopenia), náusea, vómitos y alopecia.
- El tratamiento es sintomático y medidas de soporte (administración intravenosa de antibióticos y transfusiones).
- Puede ser considerado el uso de factores de crecimiento hematopoyéticos.
- No existe antídoto específico.
Información básica al paciente
- Evitar las inmunizaciones, a no ser que el médico las apruebe.
- Los pacientes deben consultar a su médico de asistencia ante fiebre, estomatitis y/o signos de infección local.
- Se sugiere ingestión de alimentos en pequeñas cantidades y frecuentes si refiere náusea, vómitos o falta de apetito.
- Se recomienda evitar el uso de mitomicina C durante el primer trimestre de embarazo debido al potencial mutagénico y teratogénico.
- No se recomienda su uso durante el período de lactancia.
- Las mujeres en edad fértil deben evitar embarazos.
Nivel de distribución
Uso exclusivo de hospitales (Medicamento de Programa Especial)
Regulación a la prescripción
Medicamento para Programa Especial de Cáncer.
Clasificación VEN
Medicamento especial
Laboratorio productor
Internacional
Código ATC
L01DC03