Diferencia entre revisiones de «Ley periódica»
| Línea 19: | Línea 19: | ||
La semejanza de las propiedades físicas y químicas de ciertos elementos sugirió a los científicos del siglo XIX la posibilidad de ordenarlos sistemáticamente o agruparlos de a acuerdo con determinado criterio. | La semejanza de las propiedades físicas y químicas de ciertos elementos sugirió a los científicos del siglo XIX la posibilidad de ordenarlos sistemáticamente o agruparlos de a acuerdo con determinado criterio. | ||
| − | [[Johann Wolfgang Döbereiner]] ([[1780]]-[[1849]]) profesor de Química en la Universidad de Jena, hizo uno de los primeros intentos de clasificación de los elementos, cuando en [[1817]] mostró que el [[estroncio]] tenía una masa atómica aproximadamente igual a la media aritmética de las masas atómicas del Ca y del Ba, elementos similares a él. | + | [[Johann Wolfgang Döbereiner]] ([[1780]]-[[1849]]) profesor de Química en la Universidad de Jena, hizo uno de los primeros intentos de clasificación de los elementos, cuando en [[1817]] mostró que el [[estroncio]] tenía una masa atómica aproximadamente igual a la media aritmética de las masas atómicas del [[calcio]] (Ca) y del [[Bario]] (Ba), elementos similares a él. |
Posteriormente mostró la existencia de similitudes entre elementos agrupados en tríos que él denomina “triadas”. La triada del [[cloro]], del [[bromo]] y del [[yodo]] (Cl - Br - I) es un ejemplo. Pone en evidencia que la masa de uno de los tres elementos de la triada es intermedia entre la de los otros dos. En [[1850]] se contaba con unas 20 triadas para llegar a una primera clasificación coherente. | Posteriormente mostró la existencia de similitudes entre elementos agrupados en tríos que él denomina “triadas”. La triada del [[cloro]], del [[bromo]] y del [[yodo]] (Cl - Br - I) es un ejemplo. Pone en evidencia que la masa de uno de los tres elementos de la triada es intermedia entre la de los otros dos. En [[1850]] se contaba con unas 20 triadas para llegar a una primera clasificación coherente. | ||
| Línea 29: | Línea 29: | ||
El desarrollo del espectroscopio en [[1859]] por los físicos alemanes [[Robert Wilhelm Bunsen]] y [[Gustav Robert Kirchhoff]], hizo posible el descubrimiento de nuevos elementos. En [[1860]], en el primer congreso químico internacional celebrado en el mundo, el químico italiano [[Stanislao Cannizzaro]] puso de manifiesto el hecho de que algunos elementos (por ejemplo el oxígeno) poseen moléculas que contienen dos átomos. Esta aclaración permitió que los químicos consiguieran una 'lista' consistente de los elementos. | El desarrollo del espectroscopio en [[1859]] por los físicos alemanes [[Robert Wilhelm Bunsen]] y [[Gustav Robert Kirchhoff]], hizo posible el descubrimiento de nuevos elementos. En [[1860]], en el primer congreso químico internacional celebrado en el mundo, el químico italiano [[Stanislao Cannizzaro]] puso de manifiesto el hecho de que algunos elementos (por ejemplo el oxígeno) poseen moléculas que contienen dos átomos. Esta aclaración permitió que los químicos consiguieran una 'lista' consistente de los elementos. | ||
| − | Estos avances dieron un nuevo ímpetu al intento de descubrir las interrelaciones entre las propiedades de los elementos. En [[1862]], el geólogo y profesor de l'Ecole de Mines de Paris [[Alexander Emile Beguyer de Chancourtois]], envió a la Academie de Sciences de Paris un informe donde proponía una clasificación de los elementos químicos colocados sobre la superficie de un cilindro, cuya circunferencia estaba dividida en 16 partes iguales, tomando como base la masa atómica del oxígeno que es 16.[[Image:Modelo de chancourtois.JPG|thumb|left|Modelo de Chancourtois]]. | + | Estos avances dieron un nuevo ímpetu al intento de descubrir las interrelaciones entre las propiedades de los elementos. En [[1862]], el geólogo y profesor de l'Ecole de Mines de Paris (Escuela de Minas de París) [[Alexander Emile Beguyer de Chancourtois]], envió a la Academie de Sciences de Paris (Academia de Ciencias de París) un informe donde proponía una clasificación de los elementos químicos colocados sobre la superficie de un cilindro, cuya circunferencia estaba dividida en 16 partes iguales, tomando como base la masa atómica del oxígeno que es 16.[[Image:Modelo de chancourtois.JPG|thumb|left|Modelo de Chancourtois]]. |
Los elementos se disponían sobre una línea diagonal formando un ángulo de 45 º con la horizontal, dibujando una espiral de la misma forma que las hélices de un tornillo y estaban ordenados según su peso atómico creciente (expresados en números enteros), de manera que los que tenían propiedades parecidas se situaban en una misma línea vertical, evidenciando una cierta periodicidad entre los elementos de la tabla. | Los elementos se disponían sobre una línea diagonal formando un ángulo de 45 º con la horizontal, dibujando una espiral de la misma forma que las hélices de un tornillo y estaban ordenados según su peso atómico creciente (expresados en números enteros), de manera que los que tenían propiedades parecidas se situaban en una misma línea vertical, evidenciando una cierta periodicidad entre los elementos de la tabla. | ||
| Línea 35: | Línea 35: | ||
Chancourtois observó la estrecha semejanza existente entre los elementos situados en la misma linea vertical, separados por 16 unidades de masa atómica, el análisis realizado evidenció que este científico francés fue el primero en darse cuenta de que las propiedades de los elementos eran una función de su peso atómico. El sistema era más complejo pues también incluía compuestos (óxidos, amoníaco,) y aleaciones. Además el esquema resultaba complicado técnicamente de imprimir por lo que en su comunicación no se incluyó. Probablemente este hecho influyó en que su propuesta no fue demasiado conocida. | Chancourtois observó la estrecha semejanza existente entre los elementos situados en la misma linea vertical, separados por 16 unidades de masa atómica, el análisis realizado evidenció que este científico francés fue el primero en darse cuenta de que las propiedades de los elementos eran una función de su peso atómico. El sistema era más complejo pues también incluía compuestos (óxidos, amoníaco,) y aleaciones. Además el esquema resultaba complicado técnicamente de imprimir por lo que en su comunicación no se incluyó. Probablemente este hecho influyó en que su propuesta no fue demasiado conocida. | ||
| − | Dos años más tarde (1864), el químico inglés John Alexander Reina Newlands (1838-1898) dio cuenta a la Sociedad de Química Inglesa, que cuando los elementos químicos, se disponen en orden creciente de sus masas atómicas y en grupos de siete elementos, las propiedades del octavo elemento químico se parecen a la del primero, las del noveno son semejantes a las del segundo y así sucesivamente (los gases nobles no habían sido aun descubiertos), de manera que cada uno tenía propiedades similares al octavo elemento posterior. | + | Dos años más tarde ([[1864]]), el químico inglés [[John Alexander Reina Newlands]] ([[1838]]-[[1898]]) dio cuenta a la Sociedad de Química Inglesa, que cuando los elementos químicos, se disponen en orden creciente de sus masas atómicas y en grupos de siete elementos, las propiedades del octavo elemento químico se parecen a la del primero, las del noveno son semejantes a las del segundo y así sucesivamente (los gases nobles no habían sido aun descubiertos), de manera que cada uno tenía propiedades similares al octavo elemento posterior. [[Image:Ley de las octavas.JPG|thumb|right|Serie Ley de las octavas.]] |
| + | Newlands llamó a estas series ley de las octavas por su analogía con los siete intervalos de la escala musical, Newlands dividió los elementos en períodos y familia; los períodos los constituían los siete elementos consecutivos según su masa atómica y en las familias agrupó a los elementos químicos con características similares. | ||
| − | + | Esta ley no puede aplicarse a los elementos más allá del Calcio porque dejaba de cumplirse. El descubrimiento de elementos nuevos podía cuestionar la tabla que parecía cerrada, esta clasificación se considero insuficiente, y no impresionó a sus contemporáneos, probablemente porque la periodicidad observada sólo se limitaba a un pequeño número de los elementos conocidos. Su propuesta fue rechazada por la comunidad científica que lo menospreció y ridiculizó (hasta que 23 años más tarde fue reconocido por la Royal Society, que concedió a Newlands su más alta condecoración, la medalla Davy). A pesar de esto era la primera vez que se utilizaba una secuencia de masas atómicas y la tabla periódica comienza a ser diseñada. | |
| − | |||
| − | |||
Si bien el trabajo de Newlands fue incompleto, resultó de importancia, ya que puso en evidencia la estrecha relación existente entre los pesos atómicos de los elementos y sus propiedades físicas y químicas. | Si bien el trabajo de Newlands fue incompleto, resultó de importancia, ya que puso en evidencia la estrecha relación existente entre los pesos atómicos de los elementos y sus propiedades físicas y químicas. | ||
| − | En 1869, el profesor de Química Julius Lothar Meyer (1830-1895) en la Universidad de Wroclaw cuando asistió al congreso de Karlsruhe. Las conclusiones del mismo le permitieron revisar las relaciones numéricas existentes entre los elementos químicos apoyándose en la teoría atómica de Dalton y la hipótesis de Avogadro. Basándose en estas nociones determinó los volúmenes atómicos de los elementos químicos, poniendo en evidencia una cierta periodicidad en el volumen atómico. Los elementos similares tienen un volumen atómico similar en relación con los otros elementos. Los metales alcalinos tienen por ejemplo un volumen atómico importante. | + | En [[1869]], el profesor de Química [[Julius Lothar Meyer]] ([[1830]]-[[1895]]) en la Universidad de Wroclaw cuando asistió al congreso de Karlsruhe. Las conclusiones del mismo le permitieron revisar las relaciones numéricas existentes entre los elementos químicos apoyándose en la teoría atómica de Dalton y la hipótesis de Avogadro. Basándose en estas nociones determinó los volúmenes atómicos de los elementos químicos, poniendo en evidencia una cierta periodicidad en el volumen atómico. Los elementos similares tienen un volumen atómico similar en relación con los otros elementos. Los metales alcalinos tienen por ejemplo un volumen atómico importante. |
| + | |||
| + | En [[1869]] habían muchas de las piezas del rompecabezas de los elementos químicos, el químico ruso [[Dimitri Ivanovich Mendeléiev]], era consciente del trabajo de Newlands, pero no le gustaba la manera en que lo expresaba. En particular, detestaba la forma en que algunos elementos parecían haber sido metidos con calzador para mantener la impresión de periodicidad. Él se dio cuenta de que clasificando los elementos según sus masas atómicas se veía aparecer una periodicidad en lo que concierne a ciertas propiedades de los elementos y que esas propiedades tenían que dar respuesta a una ley periódica que aun no se conocía. | ||
| − | |||
== Formulación == | == Formulación == | ||
| + | === Ley periódica de Mendeléiev === | ||
| + | [[Dimitri Ivanovich Mendeléiev|Mendeléiev]] estudió el cambio las propiedades químicas de las sustancias en función del crecimiento de las masas atómicas de los elementos químicos, y analizó el comportamiento de la valencia de los elementos químicos, las propiedades y composición de los compuestos que estos forman. [[Image:Variación.JPG|thumb|right|331x114px|Variación de las propiedades.]] | ||
| − | + | Al aumentar el número atómico la composición de los óxidos de los elementos químicos se repite cada cierta cantidad de elementos químicos. [[Dimitri Ivanovich Mendeléiev|Mendeléiev]] comprobó que esto, no solo se cumplía para los áxidos, sino también para otros compuestos y para las propiedades químicas de las sustancias, lo que le llevó a la conclusión siguiente: “las propiedades de las sustancias simples, así como también de la composición y propiedades de los compuestos de los diferentes elementos químicos, se encuentran en dependencia periódica con la magnitud de sus masas atómicas”, es decir “Las propiedades de los cuerpos simples así como las formas y propiedades de los compuestos de los elementos se encuentran en dependencia periódica de los pesos atómicos de los elementos”. | |
| − | [[Dimitri Ivanovich Mendeléiev|Mendeléiev]] | + | Esta importantísima generalización se conoce como la ley periódica de [[Dimitri Ivanovich Mendeléiev|Mendeléiev]], conformándose plenamente alrededor de [[1905]], después del descubrimiento de los gases nobles. |
| − | + | La ley periódica surgió de forma totalmente empírica y antes de conocerse sus fundamentos sus descubridores y los que contribuyeron a su primitivo desarrollo nada sabían de electrones, protones o neutrones, ni de número atómico y estructura atómica. Sin embargo esto no fue un inconveniente para su inmediata utilización como norma de búsqueda de elementos desconocidos, y como principio organizado de la creciente multitud de hechos químicos. En este sentido la ley periódica y la [[Tabla Periódica de Elementos||tabla periódica]] contribuyeron notablemente al desarrollo de la [[química]] durante medio siglo. | |
| − | + | El sistema periódico de los elementos es expresión de la ley periódica, [[Dimitri Ivanovich Mendeléiev|Mendeléiev]], ordenó los elementos de acuerdo a su masa atómica y situó en una misma columna a aquellos que tenían algo en común. Su tabla, presentada en [[1869]], se basó en la variación manual de las propiedades químicas. La aceptación universal del la clasificación de Mendeleiev puede considerarse como un verdadero renacimiento del pensamiento químico. Por primera vez fueron relacionadas en un esquema lógico las variaciones de las propiedades de los elementos y sus compuestos, y dejó de ser necesario tratar un elemento como una individualidad totalmente desligada y sin relación con sus vecinos. | |
| − | + | La clave del éxito de sus esfuerzos fue comprender que los intentos anteriores habían fallado porque todavía quedaba un cierto número de elementos por descubrir, y había que dejar los huecos para esos elementos en la tabla. Por ejemplo, aunque no existía ningún elemento conocido hasta entonces con una masa atómica entre la del [[calcio]](Ca) y la del [[titanio]](Ti), [[Dimitri Ivanovich Mendeléiev|Mendeléiev]] le dejó un sitio vacante en su sistema periódico. Este lugar fue asignado más tarde al elemento [[escandio]], descubierto en [[1879]], que tiene unas propiedades que justifican su posición en esa secuencia. El descubrimiento del escandio sólo fue parte de una serie de verificaciones de las predicciones basadas en la ley periódica, y la validación del sistema periódico aceleró el desarrollo de la química inorgánica. | |
| − | + | El sistema periódico ha experimentado dos avances principales desde su formulación original por parte de Mendeléiev y Meyer La primera revisión extendió el sistema para incluir toda una nueva familia de elementos cuya existencia era completamente insospechada en el [[siglo XIX]]. Este grupo comprendía los tres primeros elementos de los gases nobles o inertes, [[argón]], [[helio]] y [[neón]], descubiertos en la atmósfera entre [[1894]] y [[1898]] por el físico británico [[John William Strutt]] y el químico británico [[William Ramsay]]. | |
| − | El | + | El segundo avance fue la interpretación de la causa de la periodicidad de los elementos en términos de la teoría de Bohr (1913) sobre la estructura electrónica del átomo. |
| − | |||
=== Ley periódica moderna === | === Ley periódica moderna === | ||
| − | + | Las bases de todo el desarrollo moderno de la química fueron sentadas en el periodo que siguió a la propuesta de [[Dimitri Ivanovich Mendeléiev|Mendeléiev]] y al desarrollo sobre la estructura atómica. | |
| + | |||
| + | El sistema periódico como indicó Mendeléiev, en [[1889]], no solo esperaba nuevas aplicaciones, sino también perfeccionamientos, un desarrollo minucioso y unas nuevas fuerzas científicas que lo impulsaran y añadió, en [[1905]], después de haber sido descubiertos los gases nobles “… a la ley periódica el futuro no lo amenaza con la destrucción, sino que solo promete superestructuras y desarrollo”. | ||
| + | |||
| + | Después de realizadas las correciones de masas atómicas y después del descubrimiento de nuevos elementos que fueron ocupando las casillas vacías de la tabla de Mendeliev, persistían, sin embargo, algunas anomalías en la tabla periódica. | ||
| − | |||
Por ejemplo: | Por ejemplo: | ||
| − | |||
| − | |||
| − | |||
| − | + | a) El [[níquel]] (Ni), que se parece más al [[paladio]] (Pd) y al [[platino]] (Pt), y debe quedar en el mismo grupo, tiene una masa atómica menor que el [[cobalto]] (Co), no debiendo situarse antes que esté en la tabla. | |
| − | + | b) El [[argón]] (Ar), que pertenece por sus propiedades al grupo de los gases nobles, tiene una masa atómica superior a la del [[potasio]] (K) que debe seguirle en orden sucesivo en la tabla. | |
| − | + | c) El [[teluro]] (Tl) que tiene una masa atómica superior al [[yodo]] (I) es muy semejante al [[azufre]] (S) y al [[selenio]] (Se), y debe estar antes que el yodo para encajar en el grupo del [[oxígeno]] (O). | |
| − | + | De acuerdo con todo esto se hizo evidente que la masa atómica creciente es un criterio de ordenamiento imperfecto para la estructuración de la tabla periódica. | |
| − | + | Realmente las causas de estas anomalías están en que las masas atómicas son las masas promedio de las mezclas de isótopos que constituyen cada elemento y están en relación con las cantidades relativas de cada clase de átomo en la mezcla isotópica. Es decir, que la masa atómica no es una propiedad de clase de átomo, sino del elemento o conjunto de átomos de igual carga nuclear. La masa atómica depende de la abundancia de cada isótopo en la mezcla y varía de acuerdo con esto para cada elemento. | |
| − | + | La siguiente etapa importante en el desarrollo de la ley periódica, está vinculada con los trabajos de [[Henry Moseley|Moseley]], quien, en [[1912]], estudiando los espectros de [[rayos X]], descubrió que las líneas características de los espectros de rayos X de los distintos elementos variaban su frecuencia en una cantidad constante al pasar de un elemento al siguiente en la tabla periódica. | |
| − | + | En [[1913]] Moseley encontró que experimentalmente la carga nuclear (Z) es una constante física de los átomos y que está íntimamente relacionada con su estructura, siendo igual al número atómico. | |
| − | + | A partir del descubrimiento de la ley de Moseley, la tabla periódica tiene como fundamento la carga nuclear y no el peso atómico. Este cambio de interpretación de la ley periódica no puede sugerir ninguna objeción de principio, puesto que la precisión de los postulados generales sobre la base de nuevos datos experimentales es una condición indispensable para el desarrollo de la ciencia. | |
| − | + | ||
Cuando se analizaron las longitudes de onda y números de onda de las rayas correspondientes a las distintas series del espectro de rayos X se encontró que cumplen la relación [[Image:Ecuaci de Moseley.JPG|thumb|center|Ecuación de Moseley]] | Cuando se analizaron las longitudes de onda y números de onda de las rayas correspondientes a las distintas series del espectro de rayos X se encontró que cumplen la relación [[Image:Ecuaci de Moseley.JPG|thumb|center|Ecuación de Moseley]] | ||
Donde σ y C son constantes que dependen del tipo de serie de espectros. A la ecuación anterior se le denomina ley de Moseley. | Donde σ y C son constantes que dependen del tipo de serie de espectros. A la ecuación anterior se le denomina ley de Moseley. | ||
| Línea 106: | Línea 107: | ||
== Referencias == | == Referencias == | ||
| − | *Lara Piñeiro. A.R. E. Calero Martín y J. Labadié Suárez: Materiales Complementarios de Química para Ingenieros. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1987. | + | *Lara Piñeiro. A.R. E. Calero Martín y J. Labadié Suárez: Materiales Complementarios de Química para Ingenieros. Ed. Pueblo y Educación. Ciudad de La Habana, [[Cuba]]. [[1987]]. |
*León Ramírez, R.: Química General. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1985 | *León Ramírez, R.: Química General. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1985 | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
== Enlaces externos == | == Enlaces externos == | ||
| + | * [http://www.portalplanetasedna.com.ar/mendeleiev.htm Biografia y Obra de Dimitri Mendeleiev La Tabla de los Elementos Químicos] | ||
| + | * [http://definicion.de/ley-periodica Portal Definición de ley periódica - Qué es, Significado y Concepto] | ||
| − | + | == Fuentes == | |
| − | |||
| − | |||
| + | * [http://www.fq.uh.cu/dpto/qf/uclv/infoLab/infoquim/asig_programs/prog.lic.quimica/temas/estruc_atom_ley_period.htm Estructura Atomica y Ley Periódica] | ||
| + | * [http://quimica-general.net16.net/ley_periodica.html Quimica General] | ||
| + | * [http://www.xtec.cat/~bnavarr1/Tabla/castellano/moseley.htm Tabla periódica - Moseley] | ||
| + | * [http://recursos.educarex.es/escuela2.0/Ciencias/Fisica_Quimica/tabla_periodica/tabla/leyperiodica.htm Ley periódica] | ||
[[Category:Química_inorgánica]] | [[Category:Química_inorgánica]] | ||
Revisión del 15:45 28 jul 2011
| ||||||
Ley Periódica. Es la base de la tabla periódica y establece que las propiedades físicas y químicas de los elementos químicos tienden a repetirse de forma sistemática conforme aumenta el número atómico.
Sumario
Desarrollo histórico
Como resultado de los descubrimientos que establecieron en firme la teoría atómica de la materia en el primer cuarto del siglo XIX, los científicos pudieron determinar las masas atómicas relativas de los elementos conocidos hasta entonces. El desarrollo de la electroquímica durante ese periodo por parte de los químicos británicos Humphry Davy y Michael Faraday condujo al descubrimiento de nuevos elementos.
Primeros intentos de clasificaciones de los elementos químicos
Aunque algunos elementos como el oro (Au), plata (Ag), cobre (Cu), plomo (Pb) y el mercurio (Hg) ya eran conocidos desde la antigüedad, el primer descubrimiento científico de un elemento ocurrió en el siglo XVII cuando el alquimista Henning Brand descubrió el fósforo (P).
En el siglo XVIII se conocieron numerosos nuevos elementos, considerándose los más importantes los gases, con el desarrollo de la química neumática: oxígeno (O), hidrógeno (H) y nitrógeno (N). También se consolidó en esos años la nueva concepción de elemento, que condujo a Antoine Lavoisier a escribir su famosa lista de sustancias simples, donde aparecían 33 elementos.
A principios del siglo XIX, la aplicación de la pila eléctrica al estudio de fenómenos químicos condujo al descubrimiento de nuevos elementos, como los metales alcalinos y alcalino-térreos, sobre todo gracias a los trabajos de Humphry Davy. En 1830 ya se conocían 55 elementos. Posteriormente, a mediados del siglo XIX, con la invención del espectroscopio, se descubrieron nuevos elementos, muchos de ellos nombrados por el color de sus líneas espectrales características: cesio (Cs, del latín caesĭus, azul), talio (Tl, de tallo, por su color verde), rubidio (Rb, rojo), etc.
La semejanza de las propiedades físicas y químicas de ciertos elementos sugirió a los científicos del siglo XIX la posibilidad de ordenarlos sistemáticamente o agruparlos de a acuerdo con determinado criterio.
Johann Wolfgang Döbereiner (1780-1849) profesor de Química en la Universidad de Jena, hizo uno de los primeros intentos de clasificación de los elementos, cuando en 1817 mostró que el estroncio tenía una masa atómica aproximadamente igual a la media aritmética de las masas atómicas del calcio (Ca) y del Bario (Ba), elementos similares a él.
Posteriormente mostró la existencia de similitudes entre elementos agrupados en tríos que él denomina “triadas”. La triada del cloro, del bromo y del yodo (Cl - Br - I) es un ejemplo. Pone en evidencia que la masa de uno de los tres elementos de la triada es intermedia entre la de los otros dos. En 1850 se contaba con unas 20 triadas para llegar a una primera clasificación coherente.
Otros químicos como: Pettenkofer, Dumas, Lenssen, Gladstone contribuyeron también a buscar relaciones entre diferentes elementos. Odling incluyó más de tres elementos en algún grupo y encontró cierta analogía entre los primeros elementos de cuatro grupos contiguos como carbono(C), nitrógeno(N), oxígeno(O) y flúor(F) cuya diferencia de pesos atómicos era menor que la que había entre dos elementos del mismo grupo. Incluso Kremers sugirió que algunos elementos podían pertenecer a dos triadas diferentes perpendiculares una a la otra. Sin embargo, debido al número limitado de elementos conocidos y a la confusión existente en cuanto a la distinción entre masas atómicas y masas moleculares, los químicos no captaron el significado de las triadas de Döbereiner.
La importancia del trabajo de Döbereiner radica en que fue el 1° intento de clasificación de los elementos. En su época eran muy pocos los elementos conocidos y los valores de los pesos atómicos todavía estaban en discusión. Esto fue el inicio de la cuadrícula que posteriormente Newlands, Odling, Meyer y el mismo Mendeleiev utilizaron hasta llegar a la clasificación periódica algunos años más tarde.
El desarrollo del espectroscopio en 1859 por los físicos alemanes Robert Wilhelm Bunsen y Gustav Robert Kirchhoff, hizo posible el descubrimiento de nuevos elementos. En 1860, en el primer congreso químico internacional celebrado en el mundo, el químico italiano Stanislao Cannizzaro puso de manifiesto el hecho de que algunos elementos (por ejemplo el oxígeno) poseen moléculas que contienen dos átomos. Esta aclaración permitió que los químicos consiguieran una 'lista' consistente de los elementos.
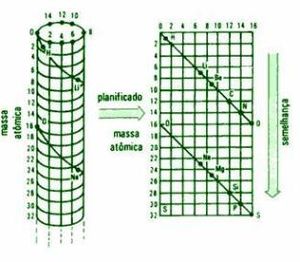
Estos avances dieron un nuevo ímpetu al intento de descubrir las interrelaciones entre las propiedades de los elementos. En 1862, el geólogo y profesor de l'Ecole de Mines de Paris (Escuela de Minas de París) Alexander Emile Beguyer de Chancourtois, envió a la Academie de Sciences de Paris (Academia de Ciencias de París) un informe donde proponía una clasificación de los elementos químicos colocados sobre la superficie de un cilindro, cuya circunferencia estaba dividida en 16 partes iguales, tomando como base la masa atómica del oxígeno que es 16..Los elementos se disponían sobre una línea diagonal formando un ángulo de 45 º con la horizontal, dibujando una espiral de la misma forma que las hélices de un tornillo y estaban ordenados según su peso atómico creciente (expresados en números enteros), de manera que los que tenían propiedades parecidas se situaban en una misma línea vertical, evidenciando una cierta periodicidad entre los elementos de la tabla.
Chancourtois observó la estrecha semejanza existente entre los elementos situados en la misma linea vertical, separados por 16 unidades de masa atómica, el análisis realizado evidenció que este científico francés fue el primero en darse cuenta de que las propiedades de los elementos eran una función de su peso atómico. El sistema era más complejo pues también incluía compuestos (óxidos, amoníaco,) y aleaciones. Además el esquema resultaba complicado técnicamente de imprimir por lo que en su comunicación no se incluyó. Probablemente este hecho influyó en que su propuesta no fue demasiado conocida.
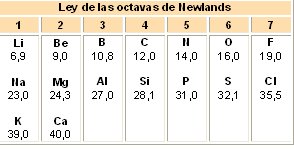
Dos años más tarde (1864), el químico inglés John Alexander Reina Newlands (1838-1898) dio cuenta a la Sociedad de Química Inglesa, que cuando los elementos químicos, se disponen en orden creciente de sus masas atómicas y en grupos de siete elementos, las propiedades del octavo elemento químico se parecen a la del primero, las del noveno son semejantes a las del segundo y así sucesivamente (los gases nobles no habían sido aun descubiertos), de manera que cada uno tenía propiedades similares al octavo elemento posterior.Newlands llamó a estas series ley de las octavas por su analogía con los siete intervalos de la escala musical, Newlands dividió los elementos en períodos y familia; los períodos los constituían los siete elementos consecutivos según su masa atómica y en las familias agrupó a los elementos químicos con características similares.
Esta ley no puede aplicarse a los elementos más allá del Calcio porque dejaba de cumplirse. El descubrimiento de elementos nuevos podía cuestionar la tabla que parecía cerrada, esta clasificación se considero insuficiente, y no impresionó a sus contemporáneos, probablemente porque la periodicidad observada sólo se limitaba a un pequeño número de los elementos conocidos. Su propuesta fue rechazada por la comunidad científica que lo menospreció y ridiculizó (hasta que 23 años más tarde fue reconocido por la Royal Society, que concedió a Newlands su más alta condecoración, la medalla Davy). A pesar de esto era la primera vez que se utilizaba una secuencia de masas atómicas y la tabla periódica comienza a ser diseñada.
Si bien el trabajo de Newlands fue incompleto, resultó de importancia, ya que puso en evidencia la estrecha relación existente entre los pesos atómicos de los elementos y sus propiedades físicas y químicas.
En 1869, el profesor de Química Julius Lothar Meyer (1830-1895) en la Universidad de Wroclaw cuando asistió al congreso de Karlsruhe. Las conclusiones del mismo le permitieron revisar las relaciones numéricas existentes entre los elementos químicos apoyándose en la teoría atómica de Dalton y la hipótesis de Avogadro. Basándose en estas nociones determinó los volúmenes atómicos de los elementos químicos, poniendo en evidencia una cierta periodicidad en el volumen atómico. Los elementos similares tienen un volumen atómico similar en relación con los otros elementos. Los metales alcalinos tienen por ejemplo un volumen atómico importante.
En 1869 habían muchas de las piezas del rompecabezas de los elementos químicos, el químico ruso Dimitri Ivanovich Mendeléiev, era consciente del trabajo de Newlands, pero no le gustaba la manera en que lo expresaba. En particular, detestaba la forma en que algunos elementos parecían haber sido metidos con calzador para mantener la impresión de periodicidad. Él se dio cuenta de que clasificando los elementos según sus masas atómicas se veía aparecer una periodicidad en lo que concierne a ciertas propiedades de los elementos y que esas propiedades tenían que dar respuesta a una ley periódica que aun no se conocía.
Formulación
Ley periódica de Mendeléiev
Mendeléiev estudió el cambio las propiedades químicas de las sustancias en función del crecimiento de las masas atómicas de los elementos químicos, y analizó el comportamiento de la valencia de los elementos químicos, las propiedades y composición de los compuestos que estos forman.Al aumentar el número atómico la composición de los óxidos de los elementos químicos se repite cada cierta cantidad de elementos químicos. Mendeléiev comprobó que esto, no solo se cumplía para los áxidos, sino también para otros compuestos y para las propiedades químicas de las sustancias, lo que le llevó a la conclusión siguiente: “las propiedades de las sustancias simples, así como también de la composición y propiedades de los compuestos de los diferentes elementos químicos, se encuentran en dependencia periódica con la magnitud de sus masas atómicas”, es decir “Las propiedades de los cuerpos simples así como las formas y propiedades de los compuestos de los elementos se encuentran en dependencia periódica de los pesos atómicos de los elementos”.
Esta importantísima generalización se conoce como la ley periódica de Mendeléiev, conformándose plenamente alrededor de 1905, después del descubrimiento de los gases nobles.
La ley periódica surgió de forma totalmente empírica y antes de conocerse sus fundamentos sus descubridores y los que contribuyeron a su primitivo desarrollo nada sabían de electrones, protones o neutrones, ni de número atómico y estructura atómica. Sin embargo esto no fue un inconveniente para su inmediata utilización como norma de búsqueda de elementos desconocidos, y como principio organizado de la creciente multitud de hechos químicos. En este sentido la ley periódica y la |tabla periódica contribuyeron notablemente al desarrollo de la química durante medio siglo.
El sistema periódico de los elementos es expresión de la ley periódica, Mendeléiev, ordenó los elementos de acuerdo a su masa atómica y situó en una misma columna a aquellos que tenían algo en común. Su tabla, presentada en 1869, se basó en la variación manual de las propiedades químicas. La aceptación universal del la clasificación de Mendeleiev puede considerarse como un verdadero renacimiento del pensamiento químico. Por primera vez fueron relacionadas en un esquema lógico las variaciones de las propiedades de los elementos y sus compuestos, y dejó de ser necesario tratar un elemento como una individualidad totalmente desligada y sin relación con sus vecinos.
La clave del éxito de sus esfuerzos fue comprender que los intentos anteriores habían fallado porque todavía quedaba un cierto número de elementos por descubrir, y había que dejar los huecos para esos elementos en la tabla. Por ejemplo, aunque no existía ningún elemento conocido hasta entonces con una masa atómica entre la del calcio(Ca) y la del titanio(Ti), Mendeléiev le dejó un sitio vacante en su sistema periódico. Este lugar fue asignado más tarde al elemento escandio, descubierto en 1879, que tiene unas propiedades que justifican su posición en esa secuencia. El descubrimiento del escandio sólo fue parte de una serie de verificaciones de las predicciones basadas en la ley periódica, y la validación del sistema periódico aceleró el desarrollo de la química inorgánica.
El sistema periódico ha experimentado dos avances principales desde su formulación original por parte de Mendeléiev y Meyer La primera revisión extendió el sistema para incluir toda una nueva familia de elementos cuya existencia era completamente insospechada en el siglo XIX. Este grupo comprendía los tres primeros elementos de los gases nobles o inertes, argón, helio y neón, descubiertos en la atmósfera entre 1894 y 1898 por el físico británico John William Strutt y el químico británico William Ramsay.
El segundo avance fue la interpretación de la causa de la periodicidad de los elementos en términos de la teoría de Bohr (1913) sobre la estructura electrónica del átomo.
Ley periódica moderna
Las bases de todo el desarrollo moderno de la química fueron sentadas en el periodo que siguió a la propuesta de Mendeléiev y al desarrollo sobre la estructura atómica.
El sistema periódico como indicó Mendeléiev, en 1889, no solo esperaba nuevas aplicaciones, sino también perfeccionamientos, un desarrollo minucioso y unas nuevas fuerzas científicas que lo impulsaran y añadió, en 1905, después de haber sido descubiertos los gases nobles “… a la ley periódica el futuro no lo amenaza con la destrucción, sino que solo promete superestructuras y desarrollo”.
Después de realizadas las correciones de masas atómicas y después del descubrimiento de nuevos elementos que fueron ocupando las casillas vacías de la tabla de Mendeliev, persistían, sin embargo, algunas anomalías en la tabla periódica.
Por ejemplo:
a) El níquel (Ni), que se parece más al paladio (Pd) y al platino (Pt), y debe quedar en el mismo grupo, tiene una masa atómica menor que el cobalto (Co), no debiendo situarse antes que esté en la tabla.
b) El argón (Ar), que pertenece por sus propiedades al grupo de los gases nobles, tiene una masa atómica superior a la del potasio (K) que debe seguirle en orden sucesivo en la tabla.
c) El teluro (Tl) que tiene una masa atómica superior al yodo (I) es muy semejante al azufre (S) y al selenio (Se), y debe estar antes que el yodo para encajar en el grupo del oxígeno (O).
De acuerdo con todo esto se hizo evidente que la masa atómica creciente es un criterio de ordenamiento imperfecto para la estructuración de la tabla periódica.
Realmente las causas de estas anomalías están en que las masas atómicas son las masas promedio de las mezclas de isótopos que constituyen cada elemento y están en relación con las cantidades relativas de cada clase de átomo en la mezcla isotópica. Es decir, que la masa atómica no es una propiedad de clase de átomo, sino del elemento o conjunto de átomos de igual carga nuclear. La masa atómica depende de la abundancia de cada isótopo en la mezcla y varía de acuerdo con esto para cada elemento.
La siguiente etapa importante en el desarrollo de la ley periódica, está vinculada con los trabajos de Moseley, quien, en 1912, estudiando los espectros de rayos X, descubrió que las líneas características de los espectros de rayos X de los distintos elementos variaban su frecuencia en una cantidad constante al pasar de un elemento al siguiente en la tabla periódica.
En 1913 Moseley encontró que experimentalmente la carga nuclear (Z) es una constante física de los átomos y que está íntimamente relacionada con su estructura, siendo igual al número atómico.
A partir del descubrimiento de la ley de Moseley, la tabla periódica tiene como fundamento la carga nuclear y no el peso atómico. Este cambio de interpretación de la ley periódica no puede sugerir ninguna objeción de principio, puesto que la precisión de los postulados generales sobre la base de nuevos datos experimentales es una condición indispensable para el desarrollo de la ciencia.
Donde σ y C son constantes que dependen del tipo de serie de espectros. A la ecuación anterior se le denomina ley de Moseley.
Estos resultados mostraron que existe una magnitud fundamental que aumenta regularmente al pasar de un elemento a otro (aumenta en unidad). Esta magnitud es evidentemente la carga eléctrica del núcleo o carga nuclear (Z).
Cuando los elementos se disponen en el orden sucesivo de sus cargas nucleares desaparecen las anomalías que se presentaban al ordenarlos según sus masas atómicas crecientes. La carga nuclear se corresponde con el número de orden en la tabla periódica o número atómico, demostrando que la verdadera base de la ley periódica no son las masas atómicas, sino las cargas positivas de los núcleos atómicos, numéricamente expresados (en unidades de carga electrónica) por los números atómicos de los correspondientes elementos químicos.
De acuerdo con esto, la ley periódica actual sólidamente está cimentada en la estructura atómica de los elementos químicos, y se expresa de la siguiente forma:
“Las propiedades físicas y químicas de los elementos son funciones de las configuraciones eslectrónicas de sus átomos, las cuales varían periódicamente al aumentar el número atómico”, postulado conocido como la Ley periódica de Moseley.
Es decir, las propiedades de los elementos varían periódicamente cuando se ordenan según sus cargas nucleares y cada cierto número de elementos las propiedades se repiten.
Referencias
- Lara Piñeiro. A.R. E. Calero Martín y J. Labadié Suárez: Materiales Complementarios de Química para Ingenieros. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1987.
- León Ramírez, R.: Química General. Ed. Pueblo y Educación. Ciudad de La Habana, Cuba. 1985
Enlaces externos
- Biografia y Obra de Dimitri Mendeleiev La Tabla de los Elementos Químicos
- Portal Definición de ley periódica - Qué es, Significado y Concepto