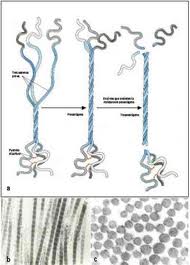
Tropoelastina
| ||||||
La Tropoelastina es una proteína de 60-72 kDa unidas alternativamente, es parte de la matriz extracelular y el precursor soluble de la elastina. Se encuentra en todos los vertebrados a excepción de los ciclostomos. Las moléculas de tropoelastina se comportan como moléculas elásticas perfectas porque pueden ser estiradas y comprimidas repetidamente en procesos completamente reversibles.
Características
Tropoelastina es una molécula soluble en agua con un peso molecular de aproximadamente 72.000 daltons. Varias moléculas de tropoelastina se unen covalentemente junto con enlaces cruzados para formar la elastina proteína que es muy frecuente en el cuerpo. No es sólo un gen para esta molécula y por lo que sólo una proteína. Sin embargo, empalme ocasional proporciona especificidad de tejido.
Hay 36 pequeños dominios en Tropoelastina y cada uno pesa aproximadamente 2 kilodaltons. Dentro de los exones, hay alterna dominios hidrófobos y ricas en lisina, esto es importante en la formación de elastina. Tropoelastina no se somete a la escisión y la formación de microfibrillas se consigue mediante un proceso de auto-asociación denominada coacervación.
Estructura
La tropoelastina humana es codificada por un solo gen que posee 34 exones y da lugar a múltiples isoformas. El mRNA codifica un polipéptido de 72 kDa dependiendo del patrón de unión y remoción que dé un péptido señal, lo cual deja una proteína madura con un peso molecular de al menos 60KDa. Por lo menos 11 formas de unión de la tropoelastina humana han sido caracterizadas , resultantes de una unión alternativa de dominios regulada progresivamente de los dominios 22, 23, 24, 26ª, 32 y 33.
La tropoelastina es una molécula asimétrica con una espiral gradual en forma de resorte a lo largo del eje axial de la molécula. Ésta región en espiral cuenta para gran parte de la elasticidad de la tropoelastina. Además de la espiral, la molécula presenta otra parte dominante y funcionalmente relevante denominada terminal C. Ésta se encuentra en el pie de la molécula (región de contacto celular) y contiene dos rasgos característicos: los únicos dos residuos de cisteína en la molécula están muy poco separados en el dominio final 36 y forman un enlace disulfuro, mientras la proteína termina en una secuencia RKRK cargada positivamente. Tanto el rompimiento de los enlaces disulfuro como la remoción de la región terminal C reducen la habilidad de la tropoelastina para ser ensamblada en las fibras en desarrollo, lo cual puede llevar a estados de enfermedad graves como la estenosis supravalcular aórtica (SVAS).
La secuencia de aminoácidos que componen ésta molécula se dividen en dominios hidrofílicos e hidrofóbicos. Los dominios hidrofóbicos son ricos en aminoácidos no polares como glicina, valina y prolina que aparecen típicamente en secuencias repetitivas. Alternándose con esos dominios hay regiones hidrofílicas caracterizadas por un alto contenido de lisina y alanina y su aporte en los enlaces cruzados.
Formación
Ésta es secretada por células de tipo elastogénico, principalmente células del músculo liso y diversos fibroblastos. La tropoelastina se auto-ensambla en glóbulos consistentes de muchos micrones de diámetro que permanecen ligados a la superficie celular. Esta etapa es el primer paso en la formación de fibras elásticas.
La producción de tropoelastina se ve afectada por la edad. La formación de ésta, en mamíferos, ocurre principalmente durante el periodo fetal y la infancia temprana y se detiene en la madurez. En caso de daños, la producción de tropoelastina puede ser rápidamente reactivada y es influenciada por factores como necrosis de tumores, factor-α, interleucina 1β, factor de crecimiento insulínico tipo 1 y fuertemente por el factor de crecimiento transformador.